Kovalente Bindung
- 2825
- 324
- Frederike Birkemeyer
Was ist eine kovalente Verbindung?
Die kovalente Bindung ist eine starke Wechselwirkung, die es zwei oder mehr Atomen ermöglicht, Moleküle zu bilden. Dies ist eine der Arten chemischer Bindungen, an denen einige Elektronen teilnehmen, die aus den äußersten Orbitalen der miteinander verbundenen Atome stammen.
Theoretisch trägt jedes Atom eines der beiden Elektronen bei, wenn sie kovalent verbinden, damit sie die Stabilität gewinnen. Das Elektronenpaar, das zu einer Art „elektronischer Haken“ zwischen den beiden Atomkern wird, wird gleichermaßen zwischen zwei identischen Atomen aufgeteilt, dies geschieht jedoch nicht, wenn die beiden Atome aus zwei verschiedenen Elementen sind.
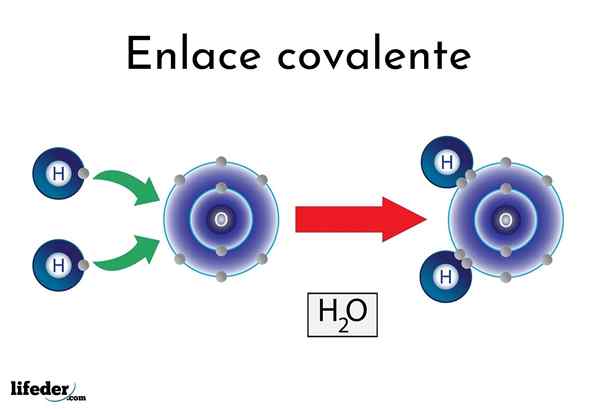
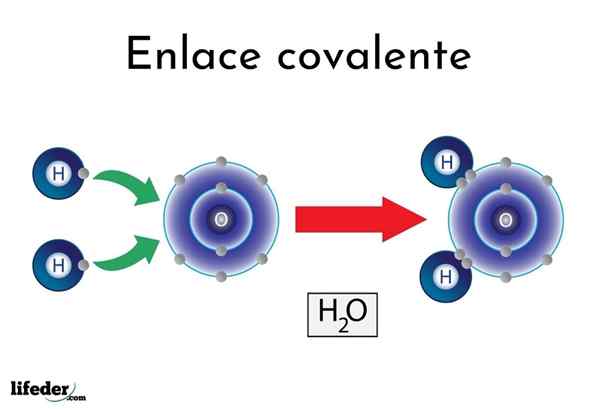 Wasserkovalente Bindung
Wasserkovalente Bindung Es gibt Atome oder Elemente, die eine natürliche Tendenz haben, Elektronen zu ergeben, während andere es vorziehen, sie zu gewinnen.
Zum Beispiel das berühmte Wassermolekül, h2Oder es hat zwei kovalente Links: h-o-h. Wasser- und Sauerstoff teilen sich die beiden Elektronenpaare, aber diese Umlaufbahn näher am Sauerstoffatom als Wasserstoff. Dieses Phänomen ist auf Polarität und Elektronegativität zurückzuführen.
Eigenschaften kovalenter Bindungen
Die kovalenten Bindungen zeigen die folgenden Eigenschaften:
-Sie umfassen ein paar Elektronen für jede kovalente Bindung.
-Die Längen werden normalerweise in PM- (Picometers) oder Armstrong (Å) Einheiten exprimiert.
-Sie sind schwer zu brechen, was bedeutet, dass sie sehr stark sind.
-Wenn sie brechen, treten chemische Veränderungen oder Transformationen auf, da das Molekül Atome verliert. In diesem Prozess wird Energie absorbiert.
-Wenn sie sich bilden, wird ein neues Molekül geboren. In diesem Prozess wird Energie freigesetzt.
Können Ihnen dienen: Chemische Reaktionen: Eigenschaften, Teile, Typen, Beispiele-Die Längen variieren je nach Avidität, die eines der verknüpften Atome gegenüber dem Elektronenpaar hat. Das heißt, je mehr es es anzieht, desto kovalenter Verbindung wird verlängert.
-Die einfachsten kovalenten Bindungen bestehen nur zwischen zwei Atomen gleichzeitig und werden mit einem Skript oder einer Zeile (-) dargestellt.
Es gibt andere Funktionen, die komplexere kovalente Verbindungen gelten, die jedoch auch dem entsprechen, was oben kommentiert wird.
Arten von kovalenten Links
Die kovalenten Bindungen können grundsätzlich auf zwei Arten klassifiziert werden: gemäß der Anzahl der geteilten Elektronen und gemäß der resultierenden Polarität, wenn das Molekül gebildet wird. Beide werden unten oberflächlich beschrieben.
Gemäß der Anzahl der gemeinsam genutzten Elektronen
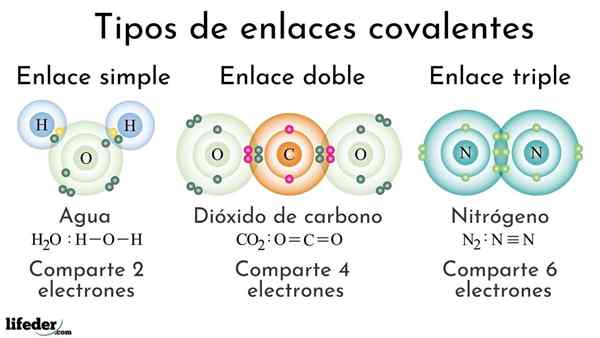 Arten von kovalenten Bindungen gemäß der Anzahl der gemeinsam genutzten Elektronen
Arten von kovalenten Bindungen gemäß der Anzahl der gemeinsam genutzten Elektronen Kovalente Bindungen gemäß der Anzahl der gemeinsam genutzten Elektronen können als einfach, doppelt oder dreifach eingestuft werden. Im oberen Bild sind diese jeweiligen Links für drei Moleküle, die unten diskutiert werden, gezeigt.
-
Einfach
Die einfache kovalente Bindung ist eine, bei der es nur ein paar Elektronen gibt, dh zwei Elektronen. Ein Beispiel für diesen Link, den wir im Wassermolekül sehen, h2ENTWEDER. Beachten. Das ist fast immer.
-
Doppelt
In der doppelten kovalenten Bindung haben wir, wie der Name schon sagt.
Das heißt, eine Doppelbindung (=) ist stärker als eine einfache (-). Es ist jedoch reaktiver, was zwar widersprüchlich erscheint, aber leicht zu erklären ist, wenn man die Überschneidung von Atomorbitalen bezieht.
Kann Ihnen dienen: Polarität (Chemie): Was ist, Definition, BeispieleEin Beispiel für diese Verbindung ist im Kohlendioxidmolekül, CO2. Die beiden Sauerstoffatome bleiben dank dieser Bindung stark zu Kohlenstoff vereint, oder = C = O, was, weil sie stärker sind, näher an Atomen; Und wiederum führt dies dazu, dass die Verbindung verkürzt wird.
-
Verdreifachen
Die dreifache Verbindung ist die stärkste und kürzeste kovalente Bindungen (häufig). Beachten Sie, dass für das Stickstoffmolekül N, n2 oder Nais, ihre durch bläulichen Kugeln dargestellten Atome liegen sehr nahe beieinander.
In der dreifachen Verbindung haben wir drei Elektronenpaare, die sechs Elektronen entsprechen, die die kovalente Bindung zwischen den beiden Atomen verstärken.
-
Dativ
Der Dative Link ist eine spezielle Art von einfacher Verbindung, die in dem Elektronenpaar besteht. Das heißt, es könnte als "erzwungenes Teilen" angesehen werden.
Zum Beispiel das M -Molekül2Oder verwenden Sie eines der sauerstofffreien Paare, um sie an ein Ion H zu spenden+ (H2O: → h+ = [H2OH]+ oder h3ENTWEDER+).
Nach Polarität
Kovalente Bindungen nach Polarität können als polar kovalent oder nicht -polarer kovalent eingestuft werden.
-
Polare kovalente Bindungen
Es tritt zwischen zwei verschiedenen Atomen auf, deren Elektronegativitätsunterschied groß ist. Dies führt zur Bildung eines Dipols, wobei sich ein Atom negativ konzentriert (anzieht Elektronen), während die anderen sich positiv konzentriert (Elektronen ergibt Elektronen). Beispielsweise ist die kovalente HF (H-F) -Bindung polar, da Fluorid elektronegativer ist als Wasserstoff.
-
Nicht -polare kovalente Verbindungen
Es tritt zwischen zwei identischen Atomen auf, deren Unterschied in der Elektronegativität Null oder sehr klein ist. Die oben erwähnten Moleküle: i2, ENTWEDER2 und n2 Sie präsentieren nicht -polare kovalente Bindungen. Daher sind Elektronen beider Atome mit der gleichen Frequenz um.
Es kann Ihnen dienen: Urethan: Struktur, Eigenschaften, erhalten, verwendet, verwendetBeispiele für kovalente Links
Schließlich werden zusätzlich zu den bereits erläuterten Kovalent -Anleihen aufgelistet, was auch auf ihre Typen hinweist:
H2S (H-S-H), einfache polare kovalent | HCL (H-CL), polar einfacher kovalenter Link |
H2 (H-H), nicht polar einfacher kovalent | C2H4 (H-C≡C-H) mit zwei einfachen polaren Links (C-H) und einer dreifachen nicht-polaren Verbindung (C)≡C) |
F2 (F-F), einfache unpolare kovalent | P2 (p≡P), nichtpolare (oder apolare) kovalente Bindung |
Co₂ (o = c = o), doppelte polare kovalent | S2 (S = S), nicht -polare Doppelkovalentbindung |
HCN (H-C≡N) mit einer einfachen polaren kovalenten Bindung (H-C) und einer anderen dreifachen polaren Verbindung (C. C≡N) | NH3 (N-H) mit drei einfachen polaren kovalenten Bindungen |
Die zitierten Beispiele entsprechen kleinen Molekülen. In allen vorhandenen Molekülen, einschließlich Polymeren, Biomolekülen, Makromolekülen, Mineralien, Keramik und Kohlenwasserstoffen, sind kovalente Bindungen vorhanden.
Verweise
- Whitten, Davis, Peck & Stanley. (2008). Chemie. (8. Aufl.). Cengage Lernen.
- Shiver & Atkins. (2008). Anorganische Chemie. (Vierte Edition). Mc Graw Hill.
- María Estela Raffino. (28. Juni 2020). Kovalente Bindung. Konzept.von. Erholt von: Konzept.von
- Wikipedia. (2020). Kovalente Bindung. Abgerufen von: in.Wikipedia.Org
- Camy Fung & Nima Mirzaee. (15. August 2020). Kovalente Bindungen. Chemistry Librettexts. Erholt von: Chem.Librettexts.Org
- Helmestine, Anne Marie, ph.D. (27. August 2020). Was ist eine kovalente Bindung in der Chemie? Erholt von: thoughtco.com

