Koordinierte kovalente Bindung
- 1682
- 156
- René Riediger
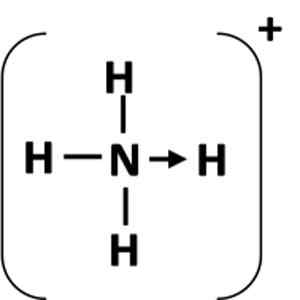
 Abbildung 1: Darstellung einer Koordinationsverbindung zwischen dem Geber (n) Atom und dem Akzeptor (H).
Abbildung 1: Darstellung einer Koordinationsverbindung zwischen dem Geber (n) Atom und dem Akzeptor (H). Was ist ein koordinierter kovalenter Link??
A Koordinierte kovalente Bindung, oder Koordinierungsverbindung, istEine Art von Verbindung, in der einer der Atome alle gemeinsam genutzten Elektronen liefert. Es wird auch als Dativ- oder bipolarer Link bezeichnet.
In einer einfachen kovalenten Verbindung liefert jedes Atom ein Elektron dem Link. Andererseits spendet in einer Koordinationsverbindung ein einzelnes Atom die Elektronen, um die Verbindung zu bilden, und wird als Giversatom bezeichnet, während das Atom, das das zu verbindende Elektronenpaar akzeptiert.
Eine Koordinationsverbindung wird durch einen Pfeil dargestellt, der von den angebenen Atomen beginnt und endet im Akzeptoratom (Abbildung 1). In einigen Fällen kann der Spender ein Molekül sein.
In diesem Fall kann ein Atom im Molekül das Elektronenpaar spenden.
Eine Koordinierungsverbindung hat ähnliche Eigenschaften wie eine einfache kovalente Bindung. Die Verbindungen, die diese Art von Verbindung aufweisen.
Einige Beispiele für koordinierte kovalente Links
Das häufigste Beispiel für eine Koordinationsverbindung ist das Ammoniumion, das durch die Kombination eines Ammoniakmoleküls und eines Protons aus einer Säure gebildet wird.
Kann Ihnen dienen: Chemische Gleichung: Teile und BeispieleIm Ammoniak hat das Stickstoffatom nach Abschluss seines Oktetts ein einsames Elektronenpaar. Fertig dieses einsame Paar mit dem Wasserstoffionen, daher wird das Stickstoffatom zum Spender. Das Wasserstoffatom wird zum Akzeptor.
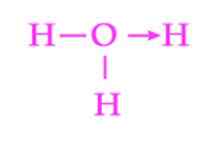 Abbildung 2: Darstellung der Koordinationsverbindung des Hydronio -Ions
Abbildung 2: Darstellung der Koordinationsverbindung des Hydronio -Ions Ein weiteres häufiges Beispiel für Dativverbindungen ist die Bildung des Hydroniumionions. Wie beim Ammoniumion dient das Paar freier Elektronen des Wassermoleküls als Geber des Protons, der der Akzeptor ist (Abbildung 2).
Es muss jedoch berücksichtigt werden, dass alle mit Sauerstoff befestigten Hydrogene, sobald die Koordinationsverbindung festgestellt wurde, genau gleichwertig sind. Wenn ein Wasserstoffionen erneut bricht, besteht keine Unterscheidung zwischen dem der Hydringen, der freigesetzt wird.
Ein hervorragendes Beispiel für eine säurebasierte Säurereaktion, die die Bildung einer koordinierten kovalenten Bindung veranschaulicht, ist die Bildungsreaktion des Bor -Trifluorid -Addukts mit Ammoniak.
Boro Trifluorid ist eine Verbindung, die keine edle Gasstruktur um das Boro -Atom hat. Bor hat nur 3 Elektronenpaare in seiner Valenzschicht, so dass der BF3 an Elektronen mangelhaft ist.
Das Stickstoff -Stickstoffdrehmoment von Ammoniak kann verwendet werden, um diesen Mangel zu überwinden, und es wird eine Verbindung gebildet, die eine Koordinationsverbindung impliziert.
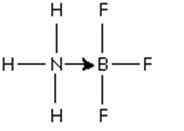 Abbildung 3: Addukt zwischen dem Bor -Trifluoridmolekül und dem Ammoniak
Abbildung 3: Addukt zwischen dem Bor -Trifluoridmolekül und dem Ammoniak Das Paar Stickstoffelektronen wird dem Orbital -P -Leer von Bor gespendet. Hier ist das Ammoniak die Basis von Lewis und BF3 ist Lewis 'Säure.
Kann Ihnen dienen: StickstoffvalencesKoordinationschemie
Es gibt einen Zweig der anorganischen Chemie, die ausschließlich der Untersuchung von Verbindungen gewidmet ist, die Übergangsmetalle bilden. Diese Metalle binden durch Koordinationsverbindungen an andere Atome oder Moleküle, um komplexe Moleküle zu bilden.
Diese Moleküle sind als Koordinationsverbindungen bekannt, und die Wissenschaft, die sie untersucht, wird als Koordinationschemie bezeichnet.
In diesem Fall ist die mit dem Metall verbundene Substanz, die der Elektronenschalter wäre, als Ligatierung bekannt, und üblicherweise sind Koordinationsverbindungen als Komplexe bekannt.
Koordinationsverbindungen umfassen Substanzen wie Vitamin B12, Hämoglobin und Chlorophyll, Farbstoffe und Pigmente sowie Katalysatoren, die bei der Herstellung von organischen Substanzen verwendet werden.
Ein Beispiel für ein komplexes Ion wäre der Kobaltkomplex [CO (NH)2CH2CH2NH2) 2clnh3]2+ Das wäre das Dichloroaminethylandiamin Cobalt (IV).
Die Koordinierungschemie entstand aus Alfred Werners Arbeit, einem Schweizer Chemiker, der verschiedene Kobaltchloridverbindungen (III) und Ammoniac untersuchte. Nach Zugabe von Salzsäure beobachtete Werner, dass Ammoniak nicht vollständig beseitigt werden konnte. Dann schlug er vor, dass das Ammoniak enger mit dem zentralen Kobalt verbunden sein sollte.
Wenn jedoch wässrige Silbernitrat hinzugefügt wurde, war eines der gebildeten Produkte festes Silberchlorid. Die Menge an Silberchlorid war mit der Anzahl der mit Kobaltchlorid verbundenen Ammoniakmoleküle (III) zusammengefasst.
Zum Beispiel, wenn Silbernitrat zu COCL hinzugefügt wurde3 · 6nh3, Die drei Chloride wurden Silberchlorid.
Wenn jedoch COCL Silbernitrat hinzugefügt wurde3 · 5nh3, Nur 2 der 3 Chloride bildeten Silberchlorid. Als es COCl war3.4nh3 Mit Silbernitrat wurde einer der drei Chloride als Silberchlorid ausgefallen.
Es kann Ihnen dienen: Píchric Acid: Was ist, Struktur, Synthese, EigenschaftenDie resultierenden Beobachtungen deuteten auf die Bildung komplexer Verbindungen oder die Koordination hin. Im internen Koordinationsbereich, der auch in einigen Texten als erste Kugel bezeichnet wird, sind die Liganden direkt mit dem zentralen Metall vereint.
Im externen Koordinationsbereich, manchmal als zweite Kugel bezeichnet, werden andere Ionen am komplexen Ion befestigt. Werner wurde 1913 für seine Koordinationstheorie mit dem Nobelpreis ausgezeichnet.
Diese Koordinationstheorie führt dazu.
Die Oxidationszahl besagt4]- und [Fecl4]2-).
Im Fall von Cobalt hat es die Koordinationsnummer 6. Aus diesem Grund wurde in Werners Experimenten das Silbernitrat hinzuge.
Die Koordinationsverbindungen dieser Art von Verbindung haben das Merkmal, gefärbt zu werden.
Tatsächlich sind sie für die typische Färbung verantwortlich, die mit einem Metall verbunden ist (rotes Eisen, blauer Kobalt usw.) und sind wichtig für spektrophotometrische Proben von Absorption und Atomemission.
Verweise
- Chemische Verbindung. Von Britannica geborgen.com.
- Kohlenkovalente Bonds (s "koordinieren.F.). Von der Chemie wiederhergestellt.Tutorvista.

