Doppelte kovalente Bindung

- 1814
- 456
- Medine Kedzierski
Wir erklären, was eine doppelte kovalente Bindung ist, ihre Eigenschaften und geben mehrere Beispiele an
 Eteno- oder Ethylenmolekül. Es ist ein typisches Beispiel für eine doppelte kovalente Bindung zwischen zwei Kohlenstoffatomen
Eteno- oder Ethylenmolekül. Es ist ein typisches Beispiel für eine doppelte kovalente Bindung zwischen zwei Kohlenstoffatomen Was ist eine doppelte kovalente Bindung??
Der Doppelte kovalente Bindungen Es sind chemische Verbindungen, in denen zwei Atome zwei Elektronenpaare teilen. Mit anderen Worten, es handelt sich um kovalente Bindungen, die durch insgesamt vier Valenzelektronen gebildet werden, die sich um zwei Atome drehen.
Doppelverbindungen sind in organischen Verbindungen sehr häufig. Zum Beispiel haben alle Alkene eine Doppelkohlenstoffbindung. Viele andere funktionelle Gruppen wie Aldehyde, Ketone, Carboxylsäuren und Amide weisen ebenfalls doppelte kovalente Bindungen zwischen Kohlenstoff und Sauerstoff auf. Andere wie Imin haben doppelte kovalente Bindungen c = n.
Doppelte Links haben viele Eigenschaften, die sie von anderen Arten von kovalenten Bindungen wie einfachen Links und dreifachen Links unterscheiden. Sie unterscheiden.
Doppelte kovalente Verbindungseigenschaften
Sie werden von 4 Elektronen gebildet
Der Grund, warum Doppelbindungen doppelte Elektronen einer einfachen kovalenten Bindung enthalten, die gebildet wird, wenn zwei Atome zwei Valenzelektronen teilen. Dies bedeutet, dass jede Doppelbindung 4 Elektronen enthält.
Sie werden durch eine Sigma -Verbindung (σ) und eine PI (π) -Blink gebildet
Von den 4 Elektronen, die eine Doppelbindung bilden, kommen 2 von ihnen zwischen einem Atom und einem anderen und gehen durch die Mitte der beiden. Dieses Elektronenpaar wird als Sigma -Elektronen bezeichnet, da sie eine Sigma -Bindung bilden (σ).
Das andere Elektronenpaar schwebt über und unter den beiden Atomen, die eine Art Sandwich machen. Diese Elektronen werden als PI -Elektronen bezeichnet und bilden eine PI (π) -Bindung.
Kann Ihnen dienen: Chlobenzol (C6H5cl)Zusammen bilden die Sigma -Verbindung und die PI -Verbindung die doppelte kovalente Bindung.
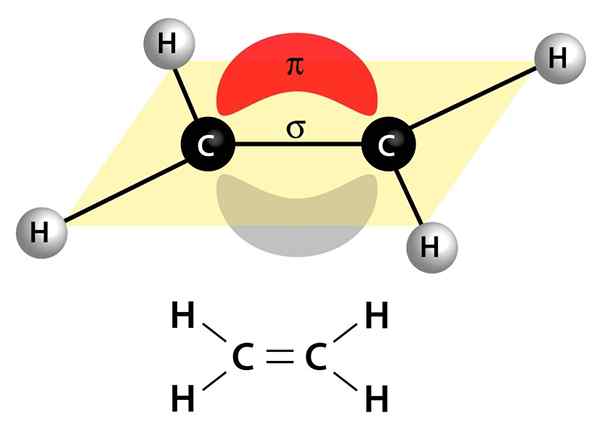 Dieses Bild zeigt die beiden Links, aus denen eine Doppelbindung besteht: die PI
Dieses Bild zeigt die beiden Links, aus denen eine Doppelbindung besteht: die PI Sie können polar oder apolar sein
Abhängig von der Elektronegativität der Atome, die durch eine doppelte kovalente Bindung vereint sind, kann es polar oder apolar sein.
Zum Beispiel eine doppelte kovalente Bindung C = c Es wird eine apolare Verbindung sein, da beide Atome gleich sind und die gleiche Elektronegativität haben. Stattdessen eine doppelte kovalente Bindung C = O Es wird polar sein, da Sauerstoff viel elektronegativer ist als Kohlenstoff.
Sie sind stärker als einfache Links
Eine Doppelbindung zu brechen ist schwieriger als das Brechen einer einfachen Verbindung zwischen den gleichen zwei Atomen. Dies liegt daran, dass sowohl ein Sigma -Link (der dem einfachen Link entspricht) als auch ein PI -Link, um eine Doppelbindung zu brechen, und ein PI -Link muss gebrochen werden. Da zwei Links anstelle eines gebrochen werden müssen, ist die Doppelbindung stärker als die einfache.
Sie sind schwächer als dreifache Verbindungen
Im Vergleich zum Dreifachverbindung ist die Doppelbindung schwächer und leichter zu brechen. Der Grund ist der gleiche wie zuvor, nur dass die Doppelbindung in diesem Fall weniger Verbindungen als das Brechen im Vergleich zum Triple -Link hat.
Sie sind kürzer als einfache Links
Doppelbindungen sind stärkere Links als einfache Links und können verknüpfte Atome näher als einfache Links bringen als einfache Links. Aus diesem Grund ist der erste immer kürzer als der zweite, wenn ein Double C = C-Link mit einem einfachen C-C-Link verglichen wird.
Kann Ihnen dienen: Natriumthiosulfat (Na2s2o3)Sie sind länger als dreifache Links
Wenn der dreifache Link stärker ist als der doppelte Link, ist der dreifache Link kürzer. Dies impliziert, dass doppelte kovalente Bindungen länger als dreifach sind.
Sie sind starre Links.
Einfache kovalente Bindungen sind sehr flexibel und können auch drehen. Andererseits sind die Doppelbindungen starr, sie sind nicht flexibel und können nicht gedreht werden, da die oben erwähnte PI -Verbindung gebrochen wird.
Sie repräsentieren Ungesättigungen
Ein Molekül mit einer Doppelbindung hat zwei weniger verknüpfte Wasserstoffatome als es hätte können. Aus diesem Grund wird gesagt, dass eine Doppelbindung eine Unsättigung darstellt (jede Unsättigung entspricht 2 Wasserstöbern).
Sie bilden flache Dreiecksmoleküle
Ein Kohlenstoffatom, das eine doppelte kovalente Bindung und zwei weitere einfache Bindungen bildet, bildet immer ein flaches Molekül, in dem die drei Bindungen auf die Enden eines Dreiecks zeigen. Diese Form wird als flache trigonale Geometrie bezeichnet.
Beispiele für doppelte kovalente Bindungen
Link C = C in Ethylen
Ethylen ist eines der einfachsten Beispiele für eine doppelte kovalente Bindung, in diesem Fall zwischen zwei Kohlenstoffatomen.
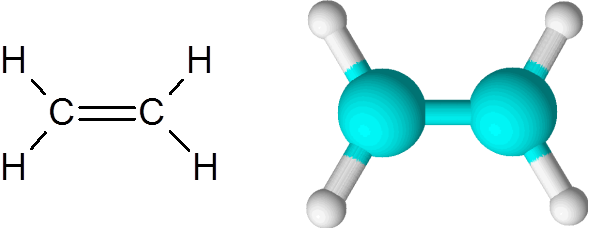 Ethylenmolekül
Ethylenmolekül Das Molekül ist vollständig flach und es ist nicht möglich, die Verbindung in eine beliebige Richtung zu drehen. Diese Doppelbindung ist völlig apolar, da sie zwei gleiche Atome verbindet.
Link C = O in Aceton
Alle Ketone enthalten eine Carbonylgruppe, die aus einem Kohlenstoffatom und einem Sauerstoffatom besteht, das mittels einer doppelten kovalenten Bindung vereint ist.
Kann Ihnen dienen: Was ist chemische Kinetik??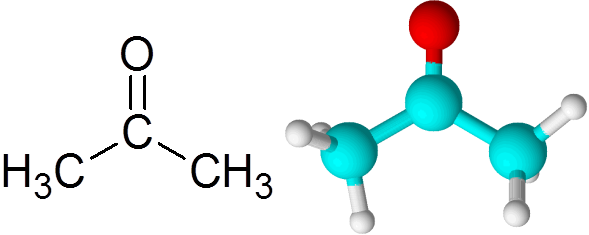 Acetonmolekül
Acetonmolekül Jedes Atom trägt zwei fehlende Elektronen bei, um sowohl die PI- als auch die Sigma -Verbindung zu bilden, aus denen die Doppelbindung besteht. Die meisten chemischen Reaktionen, die auf Ketone auftreten, sind auf die Doppelbindung c = o zurückzuführen.
Der Link o = oder im Ozonmolekül (oder3)
In diesem Fall ist das zentrale Sauerstoffatom mit zwei anderen Sauerstoffatomen verbunden. Eine der beiden Bindungen wird durch 4 Elektronen gebildet, daher entspricht sie einer doppelten kovalenten Bindung. Die drei Atome und ein paar Elektronen ohne teilen, die das zentrale Sauerstoffatom aufweisen.
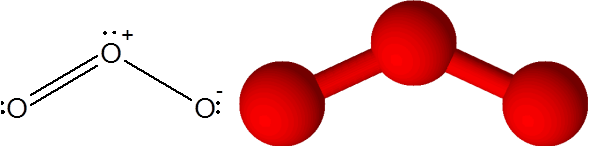 Ozonmolekül
Ozonmolekül Ozon hat die Besonderheit, dass die Doppelbindung von einem der terminalen Sauerstoff zum anderen "springen" kann. Tatsächlich tut er es sehr schnell durch einen Prozess namens Resonanz.
C = C Links im Butadieno (C4H6)
Butadieno ist ein Beispiel für eine organische Verbindung mit zwei doppelten kovalenten Bindungen c = c.
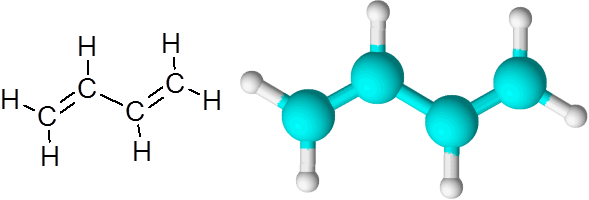 1,3-Butadien-Molekül
1,3-Butadien-Molekül Wenn die doppelten Bindungen auf diese Weise durch einen einzigen einfachen Link getrennt sind, wird gesagt, dass sie konjugierte Doppelverbindungen sind.

