Nichtpolare kovalente Bindung
- 4037
- 471
- Nick Laurén
Wir erklären, was eine nichtpolare kovalente Bindung ist, ihre Eigenschaften und mehrere Beispiele
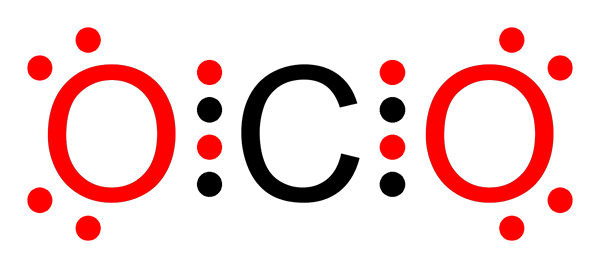
 Nicht -polare kovalente Bindung von Kohlendioxid
Nicht -polare kovalente Bindung von Kohlendioxid Was ist eine nicht -polare kovalente Bindung??
A nichtpolare kovalente Bindung, Auch als reine oder apolare kovalente Bindung bezeichnet, ist es die Vereinigung von zwei Atomen, die ein oder mehrere Elektronenpaare gleichmäßig teilen. Mit anderen Worten.
Diese Art von Verbindung liegt zwischen zwei gleichen Atomen (desselben Elements) oder zwischen zwei verschiedenen Atomen, die jedoch sehr ähnliche Elektronegativitäten aufweisen.
Es gibt drei Arten von chemischen Verbindungen, die die Atome miteinander zusammenhalten. Dies sind: die ionische Bindung, die kovalente Bindung und die metallische Verbindung. Diese Verbindungen unterscheiden sich je nach Art, wie Elektronen um Atome verteilt sind.
Bei kovalenten Bindungen teilen sich die beiden Atome die Valenzelektronen, was bedeutet, dass sich diese Elektronen, anstatt sich um ein Atom zu drehen, um die beiden drehen. Dies ist jedoch nicht immer gerecht, da Elektronen es vorziehen, mehr Zeit in der Nähe des elektronegativsten Atoms zu verbringen, was zu einer polaren kovalenten Bindung führt.
Bei nicht -polaren kovalenten Bindungen geschieht dies nicht, da beide Atome die gleiche Elektronegativität oder sehr ähnliche Elektronegativitäten aufweisen.
Eigenschaften des nicht -polaren kovalenten Zusammenhangs
1. Sie werden zwischen Atomen mit gleichen oder sehr ähnlichen Elektronegativitäten gebildet
Sie sind kovalente Verbindungen, die zwischen gleichen Atomen bilden oder sehr ähnliche Elektronegativitäten aufweisen. Im Allgemeinen wird eine kovalente Bindung als nicht polar angesehen, wenn die Differenz der Elektronegativitäten unter oder gleich 0,4 beträgt.
Kann Ihnen dienen: Succinsäure: Struktur, Eigenschaften, erhalten, verwendet, verwendet2. Sie können einfach, doppelt oder dreifach sein
Abhängig von der Anzahl der Elektronenpaare, die beide Atome teilen, können nicht -polare oder apolare kovalente Bindungen einfach, doppelt oder dreifach sein.
Wenn die Bindung durch ein einzelnes Elektronenpaar gebildet wird, wird sie als einfache Verbindung bezeichnet. Wenn zwei Elektronenpaare geteilt werden, wird sie als Doppelbindung bezeichnet. Wenn drei Elektronenpaare geteilt werden, wird sie als Triple Link bezeichnet.
3. Sie betreffen fast immer Nicht -Metalle
Metalle sind Elemente mit sehr niedrigen Elektronegativitäten, die Metallverbindungen zueinander bilden. Wenn sie mit Nicht -Metals verbunden sind, bilden sie immer entweder ionische Bindungen oder polare Links. Aus diesem Grund werden nicht -polare kovalente Bindungen zwischen nicht -metallischen Elementen wie Wasserstoff und Kohlenstoff gebildet.
4. Sie führen zu apolaren Verbindungen
Eine Verbindung, die nur nichtpolare kovalente Bindungen aufweist, wird durch apolare Moleküle gebildet. Diese Arten von Verbindungen sind durch niedrige Siede- und Fusionspunkte im Vergleich zu Metallen und ionischen Verbindungen gekennzeichnet (einige sind sogar Gase bei Raumtemperatur), sie sind in Wasser unlöslich und sind schlechte Leiter von Wärme und Elektrizität.
5. Sie können bei Raumtemperatur feste, flüssige oder gasförmige Verbindungen bilden
Verbindungen mit nicht -polaren kovalenten Bindungen können niedrige, aber sehr unterschiedliche Siede- und Fusionspunkte haben.
Aus diesem Grund sind einige von ihnen Gase bei Raumtemperatur (wie Wasserstoff, h2, und Stickstoff, n2), andere sind Flüssigkeiten (wie Bromo, Br2), während andere solide sind (wie Naphthalin, C10H8).
6. Sie haben relativ niedrige Verbindungssenergien.
Im Vergleich zu ionischen Verbindungen sind nicht -polare kovalente Bindungen leichter zu brechen, da sie eine niedrigere Verbindungsergie aufweisen. Dies bedeutet, dass Sie weniger Energie verbrauchen müssen, um eine nichtpolare kovalente Bindung zu brechen als eine ionische Bindung.
Kann Ihnen dienen: stöchiometrische GesetzeBeispiele für nicht -polare kovalente Verbindungen
H-H-Verbindung im Wasserstoffmolekül (H)2)
Im Wasserstoffmolekül H2, Zwei Wasserstoffatome teilen ihre einzigen Valenzelektronen, um eine einfache kovalente Bindung zu bilden.
 Wasserstoffmolekül
Wasserstoffmolekül Da beide Atome gleich sind, liegt der Unterschied in den Elektronegativitäten zwischen beiden Null, daher ist diese Verbindung eine nicht -polare kovalente Bindung.
F-F-Verbindung im Fluormolekül (F. F2)
In diesem Beispiel wird die Tatsache hervorgehoben, dass es keine Rolle der Elektronegativität eines Atom.
 Fluormolekül
Fluormolekül Fluor ist das elektronegativste Element des Periodensystems. Daher neigt es dazu, seine Elektronen aus den anderen Elementen zu entfernen, um polare oder ionische Bindungen zu bilden.
Wenn jedoch ein Fluoridatom mit einem anderen gleichermaßen mit ihm verbunden ist, kann auch keine Elektronen aus dem anderen entfernen (es gibt keinen Unterschied in der Elektronegativität), sodass sie keine Wahl haben, als sie genauso zu teilen und zu formen, damit so eine Form, a nicht -polarer kovalenter Verbindung.
O-o Links im Ozonmolekül (oder3)
Wie im Fall von Fluormolekül ist Sauerstoff auch ein sehr elektronegatives Element. Durch die Bildung von Verbindungen zu anderen Sauerstoffatomen bildet es jedoch nicht -polare kovalente Bindungen. Dies ist der Fall des Ozonmoleküls.
 Ozonmolekül
Ozonmolekül In diesem Fall ist das zentrale Sauerstoffatom mit zwei anderen Sauerstoffatomen mittels nichtpolarer oder apolarer kovalenter Bindungen verbunden.
Kann Ihnen dienen: Magnesiumoxid: Struktur, Eigenschaften, Nomenklatur, verwendetN-N-Verbindung im Stickstoffmolekül (n2)
Das Stickstoffmolekül enthält eine nichtpolare kovalente Bindung, in der jedes Stickstoffatom seine drei Valenzelektronen mit dem anderen verschwindet.
 Stickstoffmolekül
Stickstoffmolekül Aus diesem Grund haben beide Atome insgesamt drei Elektronenpaare und bilden so eine dreifache kovalente Bindung.
C-H-Verbindungen im Methanmolekül (CH4)
Methan ist ein Beispiel für eine nicht -polare kovalente Bindung zwischen Atomen verschiedener Elemente, in diesem Fall, Kohlenstoff und Wasserstoff.
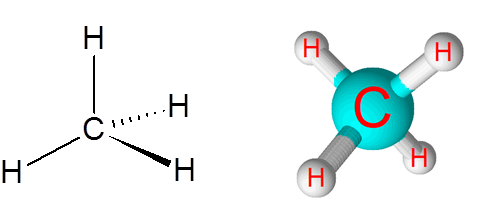 Methanmolekül
Methanmolekül Der Unterschied in der Elektronegativität zwischen den beiden Elementen beträgt 0,4, wodurch diese Grenze direkt zwischen den nichtpolaren und polaren Bindungen liegt.
Link C = C im Ethylenmolekül (C. C2H4)
Das Ethylenmolekül, auch ETeno genannt, hat insgesamt fünf Verbindungen. Vier C-H-Links und eine Doppelbindung c = c. In beiden Fällen entsprechen die Verbindungen nicht -polare oder apolare kovalente Bindungen.
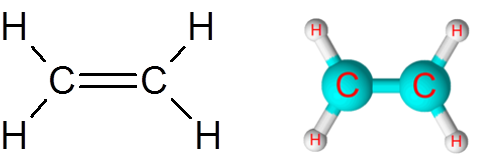 Ethylenmolekül
Ethylenmolekül
- « 6 Tänze und Tänze typisch für Quintana Roo berühmter
- Die 9 Tänze und typischen Tänze von Michoacán berühmter »

