Polare kovalente Verbindungseigenschaften und Beispiele
- 1939
- 132
- Ivan Pressler
A Polare kovalente Bindung Es bildete sich zwischen zwei chemischen Elementen, deren Elektronegativitätsunterschied erheblich ist, ohne sich jedoch einem rein ionischen Charakter zu nähern. Es ist somit eine intermediäre starke Wechselwirkung zwischen apolaren kovalenten Bindungen und ionischen Verbindungen.
Es wird gesagt, dass es kovalent ist, weil theoretisch ein elektronisches Paar zwischen den beiden verknüpften Atomen eine gerechte gemeinsame Nutzung gibt. Das heißt, die beiden Elektronen werden gleichermaßen geteilt. Das Atom e · spendet ein Elektron.
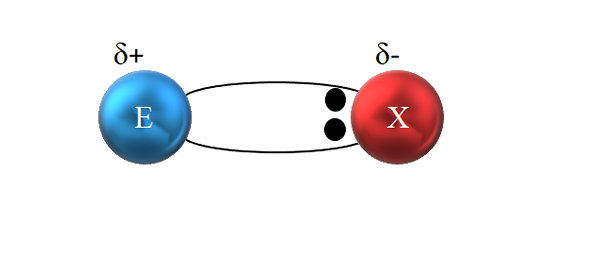
 In einer polaren kovalenten Bindung wird das Elektronenpaar nicht gerecht auf. Quelle: Gabriel Bolívar.
In einer polaren kovalenten Bindung wird das Elektronenpaar nicht gerecht auf. Quelle: Gabriel Bolívar. Wie im überlegenen Bild zu sehen ist, befinden sich die beiden Elektronen jedoch nicht in der Mitte von E und X, was darauf hinweist, dass sie mit der gleichen Frequenz zwischen beiden Atomen "zirkulieren"; sind aber näher an x als e. Dies bedeutet, dass X aufgrund seiner größeren Elektronegativität das Elektronenpaar an sich selbst angezogen hat.
Da die Elektronen der Verbindung näher an x als e sind, wird um x eine Region mit hoher elektronischer Dichte erzeugt, δ-; Während in E eine schlechte Region in Elektronen auftritt, ist δ+. Daher gibt es eine Polarisierung von elektrischen Ladungen: eine polare kovalente Bindung.
[TOC]
Eigenschaften
Polaritätsgrad
Kovalente Bindungen sind von Natur aus sehr reichlich vorhanden. Sie sind in allen heterogenen Molekülen und chemischen Verbindungen praktisch vorhanden; Da es schließlich gebildet wird, wenn zwei verschiedene Atome E und X verknüpft sind. Es gibt jedoch mehr polare kovalente Bindungen als andere, und um herauszufinden, dass Sie auf Elektronegativitäten zurückgreifen müssen.
Wie viel elektronegativer ist x und weniger elektronegatives (elektropositiv), dann wird die resultierende kovalente Bindung polarer sein. Der herkömmliche Modus zur Schätzung dieser Polarität erfolgt durch die Formel:
Kann Ihnen dienen: Natriumborhydrid (NABH4): Struktur, Eigenschaften, verwendetχX - χUND
Wobei χ die Elektronegativität jedes Atoms gemäß der Paulingskala ist.
Wenn diese Subtraktion oder Subtraktion Werte zwischen 0,5 und 2 aufweist, ist es eine polare Verbindung. Daher ist es möglich, den Polaritätsgrad zwischen mehreren E-X-Verbindungen zu vergleichen. Für den Fall, dass der erhaltene Wert höher als 2 ist, wird von einer ionischen Verbindung gesprochen, und+X- Und es ist nichtδ+-Xδ-.
Die Polarität der E-X-Verbindung ist jedoch nicht absolut, sondern hängt von molekularen Umgebungen ab. Das heißt, in einem Molekül-e-x-, wobei E- und X kovalente Bindungen mit anderen Atomen bilden, beeinflussen letztere diesen Grad der Polarität direkt.
Chemische Elemente, die sie entstehen
Während E und X ein Element sein können, entstehen nicht alle polare kovalente Bindungen. Wenn E beispielsweise ein hoch elektropositives Metall wie Alkalin (Li, Na, K, Rb und Cs) und X A A HALOG (F, CL, Br und I) ist, neigen sie dazu, ionische Verbindungen zu bilden (Na+Cl-) und nicht Moleküle (Na-Cl).
Deshalb liegen polare kovalente Bindungen normalerweise zwischen zwei nicht -metallischen Elementen; und in geringerem Maße zwischen nicht -metallischen Elementen und einigen Übergangsmetallen. Den Block sehen P Aus der Periodenverkehrstabelle gibt es viele Möglichkeiten, diese Art von chemischen Links zu bilden.
Polarer und ionischer Charakter
In großen Molekülen ist es nicht wichtig, darüber nachzudenken, wie polar eine Verbindung ist. Diese sind sehr kovalent, und die Verteilung ihrer elektrischen Ladungen (wo die reichen oder armen Regionen von Elektronen) mehr beachtet werden, um den Grad der Kovalenz ihrer internen Verbindungen zu definieren.
Kann Ihnen dienen: GaschromatographieMit zweiseitiger oder kleiner Moleküle, sagte die Polarität und jedochδ+-Xδ- Es ist ziemlich relativ.
Dies ist kein Problem mit den Molekülen zwischen nicht -metallischen Elementen; Wenn jedoch Übergangs- oder Metalloidmetalle teilnehmen, wird nicht nur eine polare kovalente Bindung gesprochen, sondern von einer kovalenten Bindung mit einem bestimmten ionischen Charakter; und im Fall von Übergangsmetallen einer kovalenten Koordinationsverbindung angesichts der Art derselben.
Beispiele für polare kovalente Bindungen
CO
Die kovalente Bindung zwischen Kohlenstoff und Sauerstoff ist polar, da die erste weniger elektronegativ ist (χC = 2,55) das der zweite (χENTWEDER = 3.44). Daher, wenn wir die Links C-O, C = O O C-O sehen-, Wir werden wissen, dass es sich um polare Links handelt.
H-X
Wasserstoffhalogenide, HX, sind ideale Beispiele, um die polare Bindung in ihren Diatommolekülen zu verstehen. Mit Wasserstoffelektronegativität (χH = 2.2) können wir schätzen, wie polar diese Halogenuros sind:
-HF (H-F), χF (3,98) - χH (2,2) = 1,78
-HCl (H-Cl), χCl (3,16) - χH (2,2) = 0,96
-HBR (H-BR), χBr (2,96) - χH (2,2) = 0,76
-Hi (h-i), χYo (2.66) - χH (2,2) = 0,46
Beachten Sie, dass der H-F-Link nach diesen Berechnungen der polarste von allen ist. Was ist sein ionischer Charakter als Prozentsatz, ist ein weiteres Thema. Dieses Ergebnis ist nicht überraschend, da Fluor das elektronegativste Element von allen ist.
Wenn die Elektronegativität von Chlor zu Jod herabsteigt, werden H-Cl, H-BR- und H-I-Links weniger polar. Die H-I-Verbindung sollte apolar sein, aber in Wirklichkeit ist er polar und auch sehr "spröde". bricht leicht.
Kann Ihnen dienen: Quecksilberhydroxid: Struktur, Eigenschaften, Verwendungen, RisikenOH
Der Polar O-H-Link ist möglicherweise der wichtigste: dank ihm gibt es ein Leben, weil er mit dem Dipolmoment des Wassers zusammenarbeitet. Wenn wir den Unterschied zwischen den Elektronegativitäten von Sauerstoff und Hydrogenen schätzen, werden wir:
χENTWEDER (3,44) - χH (2,2) = 1,24
Das Wassermolekül H2Oder es hat zwei dieser Links, h-o-h. Dies und die Winkelgeometrie des Moleküls und seiner Asymmetrie machen es zu einer hochpolaren Verbindung.
N-h
Der N-H-Link ist in den Aminogruppen von Proteinen vorhanden. Wiederholung der gleichen Berechnung, die wir haben:
χN (3.04) - χH (2,2) = 0,84
Dies spiegelt wider, dass die N-H-Verbindung weniger polar ist als O-H (1,24) und F-H (1,78).
Hässlich
Die Fe-O-Verbindung ist wichtig, da ihre Oxide in Eisenmineralien gefunden werden. Mal sehen, ob es polarer als H-O ist:
χENTWEDER (3,44) - χGlaube (1,83) = 1,61
Von hier aus wird zu Recht angenommen, dass der Fe-O-Link polarer ist als der H-O-Link (1,24); oder was ist das gleiche wie das Sagen: Fe-o hat einen größeren ionischen Charakter als h-o.
Diese Berechnungen dienen dazu, die Polaritätsgrade zwischen mehreren Verbindungen zu erscheinen. Aber sie reichen nicht aus, um zu regieren, ob eine Verbindung ionisch, kovalent oder ihr ionischer Charakter ist.
Verweise
- Whitten, Davis, Peck & Stanley. (2008). Chemie. (8. Aufl.). Cengage Lernen.
- Shiver & Atkins. (2008). Anorganische Chemie. (Vierte Edition). Mc Graw Hill.
- Laura Nappi. (2019). Polare und unpolare kovalente Bindungen: Definitionen und Beispiele. Lernen. Erholt von: Studium.com
- Helmestine, Anne Marie, ph.D. (18. September 2019). Polarkanbindungsdefinition und Beispiel (polare kovalente Bindung). Erholt von: thoughtco.com
- Elsevier b.V.(2019). Polare kovalente Bindung. Scientedirect. Abgerufen von: Scientedirect.com
- Wikipedia. (2019). Chemische Polarität. Abgerufen von: in.Wikipedia.Org
- Anonym. (5. Juni 2019). Eigenschaften von polaren kovalenten Bindungen. Chemistry Librettexts. Erholt von: Chem.Librettexts.Org
- « Original, Eigenschaften, Teile, Funktionen, Typen, Typen, Typen
- 80 Gründe, warum ich dich liebe oder liebe »

