Dreifache kovalente Bindung
- 2255
- 613
- Said Ganzmann
Wir erklären, was ein dreifacher Zusammenhang ist, seine Eigenschaften und geben mehrere Beispiele an
 Acetylenmolekül (C2H2) mit seiner dreifachen Bindung zwischen den beiden Kohlenstoffatomen
Acetylenmolekül (C2H2) mit seiner dreifachen Bindung zwischen den beiden Kohlenstoffatomen Was ist ein dreifacher kovalenter Link??
Der dreifache kovalente Bindungen Es sind chemische Verbindungen, bei denen zwei Atome drei Elektronenpaare teilen. Mit anderen Worten, es handelt sich um kovalente Bindungen, die von insgesamt sechs Valenzelektronen gebildet werden, die sich um zwei Atome drehen.
Es gibt viele chemische Verbindungen, die dreifache Verbindungen enthalten. Zum Beispiel enthalten organische Verbindungen wie Alkinne dreifache kovalente C-C-Bindungen. Nitrile sind auch durch eine Gruppe gekennzeichnet, die einen Kohlenstoff enthält, der mit Stickstoff mithilfe einer dreifachen cvalenten Bindung verbunden ist. Andere anorganische Verbindungen wie molekularer Stickstoff in der Luft enthalten ebenfalls dreifache kovalente Bindungen.
6 Elektronen, die sich um zwei Kerne drehen. Sowohl die Form der Moleküle, die sie enthalten, als auch die chemischen Reaktionen, an denen sie teilnehmen können.
Dreifache kovalente Verbindungseigenschaften
Sie werden von 6 Elektronen gebildet
Diese Bindungen werden durch 6 Elektronen gebildet und gebildet, wenn jedes der beiden betroffenen Atome drei seiner verschwundenen Elektronen mit den anderen teilt. Dies ist der Grund, warum sie als dreifache Links bezeichnet werden, da sie die Anzahl der Elektronen der einfachen kovalenten Bindung dreifach haben.
Sie haben eine Sigma -Verbindung (σ) und zwei PI (π) -Blinks
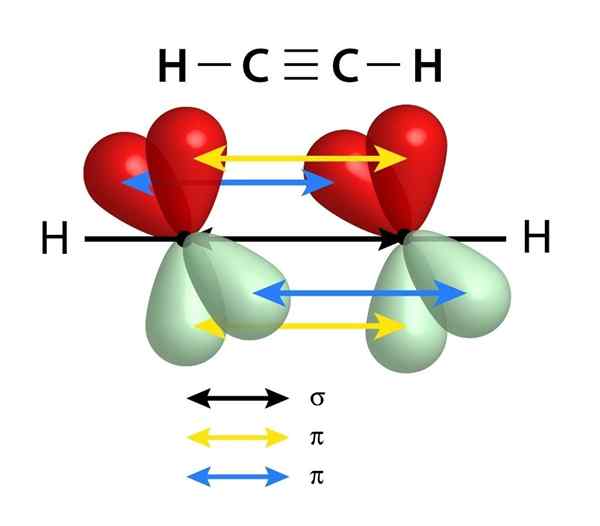 Schema der Verbindungen, die eine dreifache Verbindung zwischen zwei Kohlenstoffatomen ausmachen. Der schwarze Pfeil des Zentrums repräsentiert die Sigma -Verbindung, während Gelb und Blau jedes der beiden PI -Bindungen darstellen
Schema der Verbindungen, die eine dreifache Verbindung zwischen zwei Kohlenstoffatomen ausmachen. Der schwarze Pfeil des Zentrums repräsentiert die Sigma -Verbindung, während Gelb und Blau jedes der beiden PI -Bindungen darstellen Ähnlich wie bei Doppelbindungen werden auch dreifache Links durch einen Sigma -Link gebildet, der durch das Zentrum der Linie fließt, die sich den beiden verknüpften Atomen verbinden. Im Gegensatz zu den doppelten Links, die eine haben, haben die dreifachen Links zusätzlich zum Sigma -Link zwei PI -Links.
Kann Ihnen dienen: Kupferchlorid (i) (CUCL): Struktur, Eigenschaften, verwendetSie bilden fast immer lineare Verbindungen
Wenn zwei Kohlenstoffatome eine dreifache Verbindung bilden, hat jeder immer noch die Möglichkeit, ein zusätzliches einfaches Zusammenhang mit einem anderen Atom zu bilden (da Kohlenstoff insgesamt 4 Bindungen bilden kann).
In diesen Fällen bilden sowohl die beiden Kohlenstoffe als auch die anderen beiden an sie befestigten Atome eine gerade Linie. Diese Form, die das Molekül erfasst, wird als lineare Geometrie bezeichnet.
Sie sind die stärksten kovalenten Bindungen
Beim Vergleich der dreifachen Verbindungen zwischen zwei Atomen mit den doppelten und einfachen Bindungen zwischen denselben Atomen wird beobachtet, dass die dreifachen Verbindungen immer stärker sind als die anderen Arten der kovalenten Bindung. Dies bedeutet, dass es schwieriger ist, einen dreifachen Link zu brechen als einen doppelten oder einfachen.
Dies liegt daran.
Sie sind kürzer als Doppelbindungen oder so einfach
Aufgrund der gleichen Tatsache, stärkere Links zu sein, verwalten dreifache Links.
Sie repräsentieren zwei Unsättigungen
Jeder Kohlenstoff mit einer dreifachen Bindung hat nur einen zusätzlichen Zusammenhang mit einem anderen Atom. Dies bedeutet, dass ein solcher Kohlenstoff nur mit zwei Atomen anstelle von vier verbunden wäre, sodass er weniger Wasserstoff hat, als es besitzen könnte, wenn es nur einfache Bindungen bildet.
Kann Ihnen dienen: Heptano (C7H16): Struktur, Eigenschaften und VerwendungDies wird als Ungesättigung bezeichnet, und Verbindungen mit dreifachen Glied.
Sie sind starre Links
Wie Doppelbindungen sind dreifache Verbindungen starr und schwer zu biegen oder zu verdrehen. Dies ist sowohl auf die größere Verbindungskraft als auch auf die niedrigste Länge zurückzuführen.
Sie können als Basen fungieren
Einige Verbindungen mit dreifacher Links können die PI -Elektronen der Link verwenden, um H -Ionen zu verknüpfen oder zu akzeptieren+, Daher als Basen wirken.
Sie können sie mit Wasserstoff streichen, um doppelte oder einfache Verbindungen zu liefern
Die Unsättigung des Dreifachverbindungs. Dies nennt man Hydrierung. Wenn nur ein Wasserstoffmolekül zu einer Dreifachbindung hinzugefügt wird, wird es zu einer Doppelbindung. Wenn zwei Wasserstoffmoleküle zugesetzt werden, wird sie zu einer einfachen Bindung.
Beispiele für dreifache kovalente Links
Stickstoffmolekül (n2)
Das Stickstoffmolekül enthält eine dreifache kovalente Bindung zwischen den beiden Stickstoffatomen. Jedes Atom teilt seine drei Valenzelektronen mit dem anderen, und jedes neue Paar Elektronen wird zur Sigma -Bindung oder zu einer der beiden PI -Bindungen, die das Molekül besitzt.
 Stickstoffmolekül
Stickstoffmolekül In diesem Fall sowohl die beiden Stickstoffatome als auch die unverletzten Elektronenpaare, die sich jeweils entlang einer geraden Linie befinden.
Das Richtige (ein Alkin der Formel C3H4)
Das Richtige ist das zweit einfachste Alkin, das existiert. Diese Verbindung besteht aus einer Drei -Kohlenstoff -Kette.
Kann Ihnen dienen: ungesättigte Kohlenwasserstoffe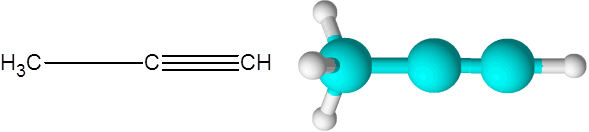 Propino -Molekül
Propino -Molekül Hier können Sie auch sehen, dass die drei Kohlenstoffe und das letzte Wasserstoffatom (das rechts) eine gerade Linie bilden. Im Modell ist auch ersichtlich, dass der einfache C-C-Link länger ist als der Triple C-C-Link.
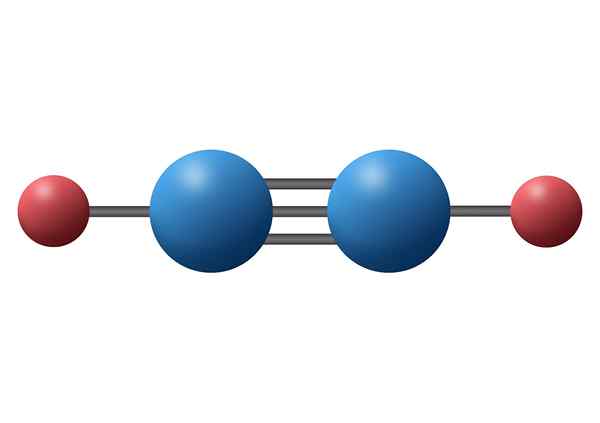
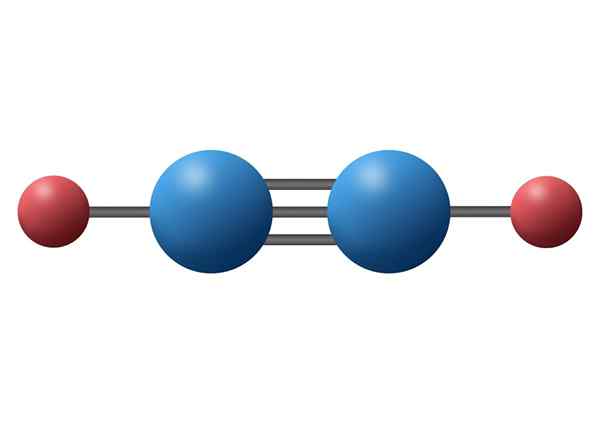
Kohlenmonoxid (CO)
Kohlenmonoxid ist ein toxisches anorganisches Gas mit einem negativen Kohlenstoffatom und einem positiven Sauerstoff, der mittels einer dreifachen kovalenten Bindung verbunden ist. In diesem Fall handelt es sich um eine polare Bindung, da die Elektronegativitäten zwischen Kohlenstoff und Sauerstoff unterschieden werden.
 Kohlenmonoxidmolekül
Kohlenmonoxidmolekül

