Ionenverbindungseigenschaften, wie Formen und Beispiele

- 4344
- 1226
- Nick Laurén
Er Ionic Link Es handelt. Das heißt, ein positiv geladenes Ionen bildet eine Verbindung mit einem negativ belasteten Ion, das Elektronen von einem Atom auf ein anderes überträgt.
Diese Art der chemischen Bindung tritt auf, wenn die Valenzelektronen eines Atoms dauerhaft auf ein anderes übertragen werden. Das Atom, das Elektronen verliert, wird zu einem Kation (positiv beladen), und derjenige, der Elektronen gewinnt, wird zu einem Anion (negativ belastet).
 Ionenbindungsbeispiel: Natriumfluorid. Das Natrium verliert ein Valencia -Elektron und verleiht es Fluorid. WDCF [CC BY-S (https: // createRecommons.Org/lizenzen/by-sa/3.0)]]
Ionenbindungsbeispiel: Natriumfluorid. Das Natrium verliert ein Valencia -Elektron und verleiht es Fluorid. WDCF [CC BY-S (https: // createRecommons.Org/lizenzen/by-sa/3.0)]] [TOC]
Ionic Link Concept
Die ionische Bindung ist die, durch die elektrisch geladene Partikel, die Ionen genannt werden, interagieren, um zu ionischen Feststoffen und Flüssigkeiten zu führen. Diese Verbindung ist das Produkt elektrostatischer Wechselwirkungen zwischen Hunderten von Millionen von Ionen und ist nicht nur auf einige von ihnen begrenzt. Das heißt, es geht über die Anziehungskraft zwischen einer positiven Belastung in Richtung einer negativen Belastung hinaus.
Betrachten Sie zum Beispiel die ionische Verbindung Natriumchlorid NaCl, am besten als Tischsalz bekannt. In der NaCl überwiegt die ionische Bindung, sodass sie aus na -Ionen besteht+ und Cl-. Dann ein+ Es ist das positive Ion oder Kation, während der CL- (Chlorid) ist das negative Ion oder Anion.
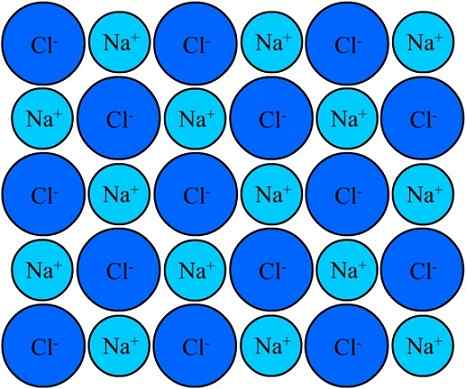 Die Na+ und die Klassen in Natriumchlorid bleiben dank der ionischen Bindung vereint. Quelle: Eyal Bairey über Wikipedia.
Die Na+ und die Klassen in Natriumchlorid bleiben dank der ionischen Bindung vereint. Quelle: Eyal Bairey über Wikipedia. Sowohl die Na+ Wie der Cl- Sie werden als entgegengesetzte elektrische Lasten angezogen. Die Entfernungen zwischen diesen Ionen ermöglichen es anderen, sich zu nähern, so dass NaCl -Paare und Paare erscheinen. NA -Kationen+ Sie werden miteinander abgewiesen, weil sie gleiche Belastungen sind, und das Gleiche passiert mit den Cl -Anionen miteinander-.
Es kommt eine Zeit, in der Millionen von Na -Ionen+ und Cl- Sie schaffen es, eine Struktur zu vereinen, zusammenzusetzen, die so stabil wie möglich ist. Ein durch die ionische Verbindung (überlegenes Bild) regiert. NA -Kationen+ Sie sind kleiner als Clanionen- Wegen der wachsenden wirksamen Kernkraft seines Kerns an externen Elektronen.
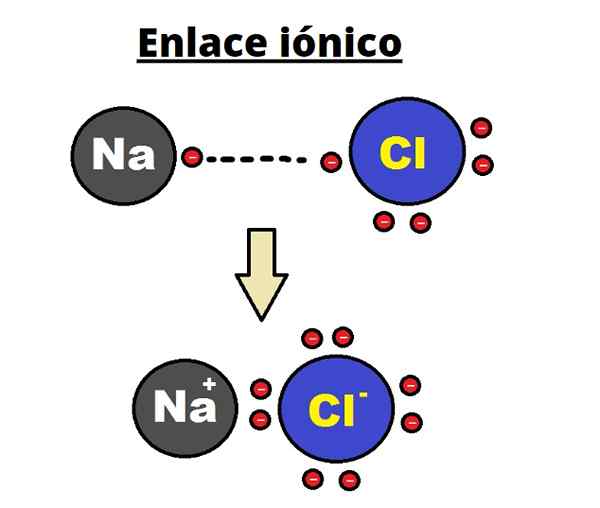 NaCl Ionic Link. Rhannosh/CC BY-SA (https: // creativecommons.Org/lizenzen/by-sa/3.0)
NaCl Ionic Link. Rhannosh/CC BY-SA (https: // creativecommons.Org/lizenzen/by-sa/3.0) Die ionische Bindung ist durch die Festlegung geordneter Strukturen gekennzeichnet, bei denen der Abstand zwischen den Ionen (NA+ und Cl- Im Fall von NaCl) ist es im Vergleich zu anderen Feststoffen gering. Es ist die Rede einer ionischen kristallinen Struktur.
Wie ist eine ionische Verbindung??
Die Ionenbindung erfolgt nur, wenn eine Elektronenverteilung auftritt, sodass Ionenlasten auftreten. Diese Art von Verbindung kann niemals zwischen neutralen Partikeln auftreten. Es muss notwendigerweise Kationen und Anionen geben. Aber woher kommen sie??
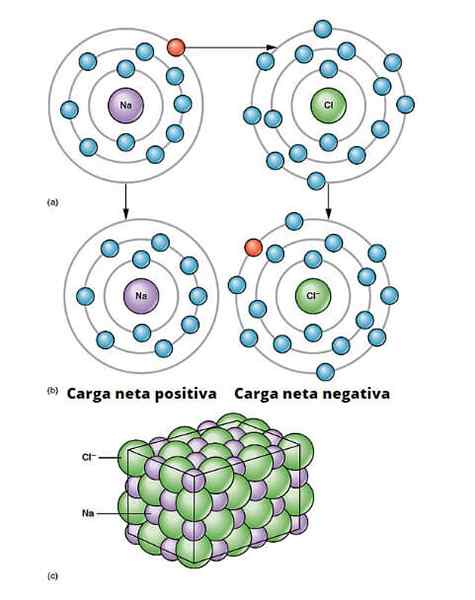 Ionic Link Illustration. A) Natrium hat eine negative Nettobelastung. b) Natrium verleiht Chlor ein Elektron. Das Natrium hat eine positive Nettobelastung und das Chlor mit negativer Nettobelastung, wodurch die ionische Bindung erzeugt wird. Diese Art von Verbindung zwischen Millionen von NA und CL -Atomen führt zu physischen Salz. OpenX College/CC BY (https: // creativeCommons.Org/lizenzen/bis/3.0)
Ionic Link Illustration. A) Natrium hat eine negative Nettobelastung. b) Natrium verleiht Chlor ein Elektron. Das Natrium hat eine positive Nettobelastung und das Chlor mit negativer Nettobelastung, wodurch die ionische Bindung erzeugt wird. Diese Art von Verbindung zwischen Millionen von NA und CL -Atomen führt zu physischen Salz. OpenX College/CC BY (https: // creativeCommons.Org/lizenzen/bis/3.0) Es gibt viele Möglichkeiten, für die Ionen entstehen, aber im Wesentlichen basieren viele auf einer Oxidationsreduktionsreaktion. Die meisten anorganischen ionischen Verbindungen bestehen aus einem metallischen Element mit einem nicht -metallischen Element (denen des Blocks P der Periodenzüchter).
Das Metal muss oxidieren, Elektronen verlieren, sich in ein Kation verwandeln. Andererseits wird das nicht -metallische Element reduziert, gewinnt diese Elektronen und wird zu einem Anion. Das folgende Bild zeigt diesen Punkt für die Bildung von NaCl aus Natrium- und Chloratomen:
Kann Ihnen dienen: Arsensäure (H3SO4): Eigenschaften, Risiken und Verwendung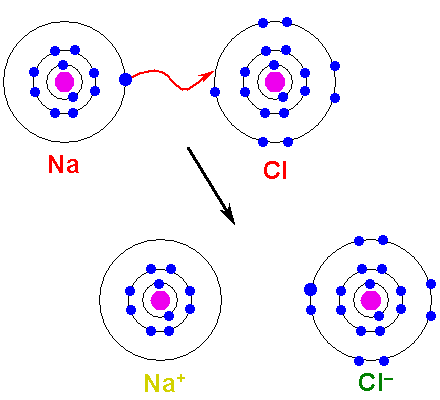 Bildung einer ionischen Verbindung. Quelle: Shafei bei arabischer Wikipedia / Public Domain
Bildung einer ionischen Verbindung. Quelle: Shafei bei arabischer Wikipedia / Public Domain Das NA Atom spendet eine seiner Valencia -Elektronen an die CL. Wenn diese Elektronenverteilung auftritt, werden NA -Ionen gebildet+ und Cl-, die sofort und elektrostatisch anziehen.
Es wird daher gesagt, dass na+ und Cl- Sie teilen kein Elektronenpaar, im Gegensatz zu dem, was für eine hypothetische NA-C-CAVOVENT-Bindung zu erwarten ist.
Ionenverbindungseigenschaften
Die ionische Bindung ist nicht leitend, dh ihre Stärke ist nicht in eine einzelne Richtung vorhanden, sondern wird durch den Raum basierend auf den Entfernungen verbreitet, die die Ionen trennen. Diese Tatsache ist wichtig, da dies bedeutet, dass die Ionen stark vereint sind, was einige der physikalischen Eigenschaften ionischer Feststoffe erklärt.
Schmelzpunkt
Die ionische Bindung ist für Salz zu einer Temperatur von 801 ºC verantwortlich. Diese Temperatur ist im Vergleich zu den Fusionspunkten mehrerer Metalle erheblich hoch.
Dies liegt daran, dass NaCl genügend Wärme absorbieren muss, damit seine Ionen frei außerhalb ihrer Kristalle fließen; Das heißt, die Attraktionen zwischen NA müssen überwunden werden+ und Cl-.
Siedepunkt
Die Fusions- und Siedepunkte von ionischen Verbindungen sind besonders ein hohes Produkt ihrer starken elektrostatischen Wechselwirkungen: ihre ionische Bindung. Da diese Verbindung jedoch viele Ionen umfasst, wird dieses Verhalten normalerweise an intermolekulare Kräfte und nicht richtig an die ionische Bindung vergeben.
Bei Salz wird nach dem Schmelzen des NaCl eine Flüssigkeit aus denselben anfänglichen Ionen erhalten; Erst jetzt bewegen sie sich mit größerer Freiheit. Der ionische Link ist noch vorhanden. Na -Ionen+ und Cl- Sie treffen sich auf der Oberfläche der Flüssigkeit, um eine große Oberflächenspannung zu erzeugen, die verhindert, dass Ionen der Gasphase entkommen.
Daher muss geschmolzenes Salz seine Temperatur zum Kochen weiter erhöhen. Der Siedepunkt von NaCl beträgt 1465 ºC. Bei dieser Temperatur übersteigt die Wärme die Attraktionen zwischen NA+ und Cl- In der Flüssigkeit beginnen sich NaCl -Dämpfe mit einem Druck zu bilden, der der Atmosphäre entspricht.
Elektronegativität
Früher wurde gesagt, dass die ionische Bindung zwischen einem metallischen Element und einem nicht -metallischen Element gebildet wird. In summarischen Berichten: zwischen einem Metall und einem Nicht -Metall. Normalerweise ist dies in Bezug auf anorganische ionische Verbindungen; Vor allem die des Binärtyps wie NaCl.
Für die Elektronenverteilung (NA+Cl-) und nicht eine Teile (NA-CL), es muss einen großen Elektronegativitätsunterschied zwischen beiden Atomen geben. Andernfalls würde es keine ionische Verbindung zwischen ihnen zwei geben. Möglicherweise "Wechselwirkung des NA- und der CL.
Dieses Szenario gilt jedoch nur für binäre Verbindungen, MX, wie z. B. NaCl. Für andere Salze oder ionische Verbindungen sind ihre Trainingsprozesse komplizierter und können nicht aus einer lediglichen atomaren oder molekularen Perspektive angegangen werden.
Es kann Ihnen dienen: AlquinosLeute
Es gibt keine unterschiedlichen Arten von ionischen Bindungen, da das elektrostatische Phänomen rein physisch ist und nur die Art und Weise variiert, wie die Ionen interagieren oder die Anzahl der Atome, die sie besitzen; Das heißt, wenn sie monoatomische oder polyiatomische Ionen sind. Außerdem verursacht jedes Element oder jede Verbindung ein charakteristisches Ion, das die Art der Verbindung definiert.
In dem Abschnitt Beispiele wird dieser Punkt vertieft, und es wird ersichtlich, dass die ionische Verbindung in allen Verbindungen im Wesentlichen gleich ist. Wenn dies nicht erfüllt ist, wird gesagt, dass die ionische Bindung einen bestimmten kovalenten Charakter hat, was bei vielen Übergangsmetallen der Fall ist, bei denen die Anionen mit Kationen koordiniert werden. Zum Beispiel FECL3 (Glaube3+-Cl-).
Beispiele für ionische Verbindungen
Im Folgenden werden mehrere ionische Verbindungen aufgeführt, und ihre Ionen und Proportionen werden hervorgehoben:
- Magnesiumchlorid
Mgcl2, (Mg2+Cl-) In einem 1: 2 -Verhältnis (mg2+: 2 Cl-)
- Kaliumfluorid
Kf, (k)+F-) In einem 1: 1 -Verhältnis (k)+: F-)
- Natriumsulfid
N / A2S, (na+S2-) In einem Anteil 2: 1 (2+: S2-)
- Lito Hydroxid
Lioh, (li+Oh-) In einem 1: 1 -Verhältnis (li+: Oh-)
- Kalziumfluorid
CAF2, (AC2+F-) In einem 1: 2 -Verhältnis (ca2+: 2f-)
- Natriumcarbonat
N / A2CO3, (N / A+CO32-) In einem Anteil 2: 1 (2+: Co32-)
- Kalziumkarbonat
Dieb3, (AC2+CO32-) In einem 1: 1 -Verhältnis (ca2+: Co32-)
- Kaliumpermanganat
Kmno4, (K+Mne4-) In einem 1: 1 -Verhältnis (k)+: Mn4-)
- Kupfersulfat
Cuso4, (Cu2+SW42-) In einem 1: 1 -Verhältnis (cu2+: SO42-)
- Bariumhydroxid
Ba (oh)2, (Ba2+Oh-) In einem 1: 2 -Verhältnis (ba2+: Oh-)
- Aluminiumbromid
Alb3, (Zum3+Br-) in einem 1: 3 -Verhältnis (zu3+: 3br-)
- Eisenoxid (III)
Glaube2ENTWEDER3, (Glaube3+ENTWEDER2-) In einem Anteil 2: 3 (2FE3+: 32-)
- Strontiumoxid
Sro (sr2+ENTWEDER2-) In einem 1: 1 -Verhältnis (sr2+: ENTWEDER2-)
- Silberchlorid
AGCL (AG+Cl-) In einem 1: 1 -Verhältnis (Ag+: Cl-)
- Andere
-CH3Cona, (wählen Sie3Gurren-N / A+) In einem 1: 1 -Verhältnis (Cho3Gurren-: N / A+)
- NH4Ich (NH4+Yo-) In einem 1: 1 -Verhältnis (NH4+: Yo-)
Jede dieser Verbindungen zeigt eine ionische Bindung, bei der Millionen von Ionen, die ihren chemischen Formeln entsprechen, elektrostatisch angezogen werden und einen Feststoff entstehen. Je größer die Größe seiner ionischen Belastungen ist, desto intensiver werden die Attraktionen und elektrostatischen Abstoßungen sein.
Daher ist eine ionische Bindung in der Regel stärker, je größer die Ladungen der Ionen, aus denen die Verbindung besteht.
Kann Ihnen dienen: AlkeneGelöste Übungen
Einige Übungen, die das Grundkenntnis des Ionic Links vermitteln, werden unten gelöst.
- Übung 1
Welche der folgenden Verbindungen ist ionisch? Die Optionen sind: HF, H2Oder, nah, h2S, NH3 und Mgo.
Eine ionische Verbindung muss per Definition eine ionische Bindung aufweisen. Je größer der Unterschied in der Elektronegativität zwischen seinen Komponentenelementen ist, desto größer ist der ionische Charakter der Link.
Optionen, die kein metallisches Element haben, werden im Prinzip verworfen: hf, h2Oder h2S und NH3. Alle diese Verbindungen werden nur durch nicht -metallische Elemente gebildet. Das Kation NH4+ Es ist eine Ausnahme von dieser Regel, weil sie kein Metall hat.
Die verbleibenden Optionen sind NAH und MGO, die jeweils NA- und Mg -Metalle haben, die nicht -metallischen Elementen vereint sind. Nah (Na+H-) und mgo (mg2+ENTWEDER2-) Sie sind ionische Verbindungen.
- Übung 2
Betrachten Sie die folgende hypothetische Verbindung: Ag (NH4)2CO3Yo. Was sind Ihre Ionen und in welchem Verhältnis stehen sich im Festen??
Zersetzung der Verbindung auf ihren Ionen, die wir haben: Ag+, NH4+, CO32- und ich-. Diese werden elektrostatisch dem Anteil 1: 2: 1: 1 (Ag+: 2nh4+: Co32-: Yo-). Bedeutet, dass die Anzahl der Kationen NH4+ Es ist doppelt so+, CO32- und ich-.
- Übung 3
Welche der folgenden Verbindungen wäre grundsätzlich zu erwarten, dass die stärkste ionische Verbindung hatte? Die Optionen sind: KBR, CAS, NA2SW4, Cuo, Alpo4 und pb3P4.
Der KBR besteht aus Kionen+ und Br-, Mit einer Lastgröße. Dann hat CAS die CA -Ionen2+ und s2-, Bei Lasten der doppelten Größe kann man gedacht werden, dass die ionische Verbindung in CAS stärker ist als in KBR; Und auch stärker als in na2SW4, Da sich letzteres aus NA -Ionen zusammensetzt+ Und so42-.
Sowohl CAS als auch CUO können eine gleiche starke ionische Verbindung haben, da beide Ionen mit doppelten Größenlasten enthalten. Dann haben wir Alpo4, mit Ionen al3+ und po43-. Diese Ionen haben dreifache Belastungen, so dass die ionische Verbindung in Alpo4 Es sollte stärker sein als in allen oben genannten Optionen.
Und schließlich haben wir den Gewinner PB3P4, Nun, wenn wir davon ausgehen, dass es von Ionen gebildet wird, werden sie PB4+ Und P3-. Ihre Lasten haben die größten Größen; Und damit pb3P4 Es ist die Verbindung, die wahrscheinlich die stärkste ionische Bindung hat.
Verweise
- Whitten, Davis, Peck & Stanley. (2008). Chemie. (8. Aufl.). Cengage Lernen.
- Shiver & Atkins. (2008). Anorganische Chemie. (Vierte Edition). Mc Graw Hill.
- Wikipedia. (2020). Ionenbindung. Abgerufen von: in.Wikipedia.Org
- Helmestine, Anne Marie, ph.D. (11. Februar 2020). Ionische gegen kovalente Bindungen - den Unterschied verstehen. Erholt von: thoughtco.com
- Die Herausgeber von Enyclopaedia Britannica. (31. Januar 2020). Ionenbindung. Encyclopædia Britannica. Erholt von: Britannica.com
- Chemicool -Wörterbuch. (2017). Definition der ionischen Bindung. Erholt von: Chemicoolool.com
- « Granrataria Balance -Funktionen, Teile und wie man sie benutzt
- Rutherford History Atomic Model, Experimente, Postulate »

