PI Link
- 3083
- 740
- Timo Rabenstein
Wir erklären, was der PI -Link ist, wie seine Eigenschaften gebildet werden, und wir geben mehrere Beispiele an
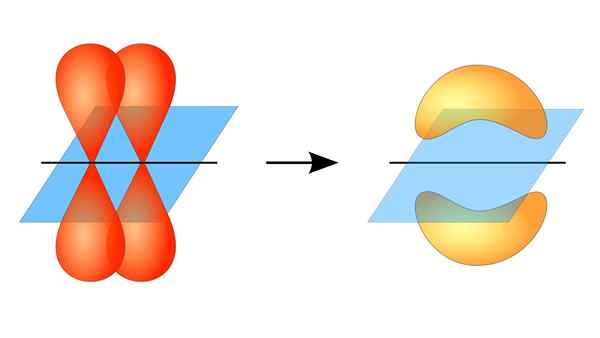
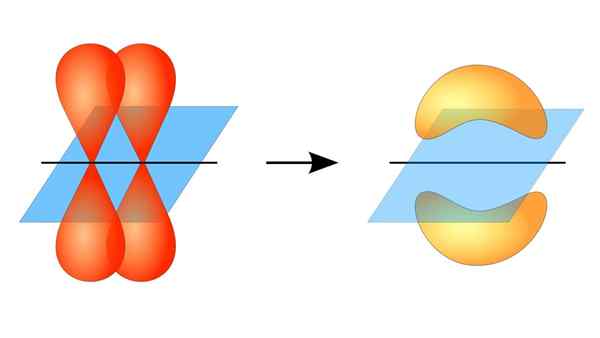 Zwei Orbitale p, die eine Verbindung π bilden
Zwei Orbitale p, die eine Verbindung π bilden Was ist ein PI -Link?
A PI Link (π) Es handelt sich um eine kovalente Art von Verbindung, die durch Verhinderung der freien Rotationsbewegung von Atomen gekennzeichnet ist und zwischen einem Paar reiner Atomorbitale stammt, unter anderem die Besonderheiten. Es gibt Verbindungen, die zwischen Atomen durch ihre Elektronen gebildet werden können, die es ihnen ermöglichen, größere und komplexere Strukturen aufzubauen: Moleküle.
Diese Links können unterschiedliche Sorten sein, aber die häufigsten in diesem Studienbereich sind kovalent. Die kovalenten Bindungen, auch Molekular genannt, sind eine Art von Verbindung, bei der die beteiligten Atome Elektronenpaare teilen.
Dies kann aufgrund der Notwendigkeit von Atomen auftreten, nach Stabilität zu suchen und so die meisten bekannten Verbindungen zu bilden. In diesem Sinne können kovalente Bindungen je nach Konfiguration ihrer Orbitale und der Menge der zwischen den beteiligten Atomen gemeinsam genutzten Elektronenpaare einfach, doppelt oder dreifach sein.
Aus diesem Grund gibt es zwei Arten von kovalenter Bindung, die zwischen Atomen basierend auf der Ausrichtung ihrer Orbitale gebildet werden: die Sigma (σ) -Bindungen und die PI (π) -Linke (π) (π).
Es ist wichtig, beide Links zu unterscheiden, da die Sigma -Verbindung in einfachen Gewerkschaften und dem PI in mehreren Gewerkschaften zwischen Atomen dargestellt wird (zwei oder mehr Elektronen werden geteilt).
Wie sind die PI -Linkformen?
Um die Bildung des PI -Links zu beschreiben, sollte es zunächst über den Hybridisierungsprozess erörtert werden, da es in einigen wichtigen Links greift.
Hybridisierung ist ein Prozess, bei dem sich hybride elektronische Orbitale gebildet haben. Das heißt, wo atomare Sub -Level -Orbitale S und P gemischt werden können. Dies führt zur Bildung von SP, SP -Orbitalen2 und sp3, die als Hybriden bezeichnet werden.
Kann Ihnen dienen: reversible Reaktion: Eigenschaften und BeispieleIn diesem Sinne erfolgt die Bildung der PI -Links dank der Überlappung einiger Lappen, die zu einem atomaren Orbital an einem anderen Paar von Lappen gehören, das in einem Orbital ist, das Teil eines anderen Atoms ist.
Diese orbitale Überlappung erfolgt seitlich, sodass die elektronische Verteilung über und unter der Ebene konzentriert ist.
Wenn Sie über die Orbitalsymmetrie dieser Art von Gewerkschaft sprechen, sollte erwähnt werden, dass es gleich der des P -Orbitals Typ P ist, solange sie durch die durch die Verbindung gebildete Achse beobachtet wird. Darüber hinaus werden diese Gewerkschaften hauptsächlich aus Orbitalen p bestehen p.
PI -Bindungsbildung bei verschiedenen chemischen Spezies
Da die PI -Bindungen immer von ein oder zwei weiteren Links (ein Sigma oder ein anderes PI und ein Sigma) begleitet werden, ist es relevant zu wissen, dass die zwischen zwei Kohlenstoffatomen gebildete Doppelbindung (konstituiert aus einer Sigma -Bindung und einem PI) besteht (ein PI)) besitzt eine geringere Verbindungsergie als die, die dem doppelten Sigma -Verknüpfung zwischen den beiden entspricht.
Dies wird durch die Stabilität der Sigma -Verbindung erklärt, die größer als die der PI -Bindung ist Kerne.
Trotzdem, wenn PI- und Sigma -Links ein mehrfach lauterer Link als der einfache Link für sich selbst kombiniert werden, der durch Beobachtung der Verbindungslängen zwischen verschiedenen Atomen mit einfachen und mehreren Links überprüft werden kann.
Kann Ihnen dienen: nicht -metallische OxideEs gibt einige chemische Arten, die anhand ihres außergewöhnlichen Verhaltens untersucht werden, wie z. B. Koordinationsverbindungen mit Metallelementen, bei denen die zentralen Atome nur durch PI -Bindungen vereint sind.
PI -Link -Eigenschaften
Erlaubt die freie Rotationsbewegung von Atomen nicht
Die Merkmale, die die PI -Verbindungen von anderen Arten von Wechselwirkungen zwischen Atomarten unterscheiden. Aus diesem Grund tritt ein Bindungsbruch auf, wenn es eine Rotation der Atome gibt.
Überlappung zwischen Orbitalen durch zwei parallele Regionen
Ebenso erfolgt die Überlappung zwischen den Orbitalen in zwei parallelen Regionen, sodass sie eine größere Diffusion aufweisen als die Sigma -Bindungen und dass sie aus diesem Grund schwächer sind.
Zwischen ein paar reinen Atomorbitalen
Andererseits wird, wie oben erwähnt, die PI -Verbindung immer unter einem Paar reiner Atomorbitale erzeugt. Dies bedeutet zwischen Orbitalen, die keine Hybridisierungsprozesse erlitten haben, bei denen die Dichte der Elektronen größtenteils über und unter der Ebene konzentriert ist, die von der kovalenten Gewerkschaft gebildet wird.
In diesem Sinne kann zwischen einigen Atomen mehr als ein PI -Link vorgestellt werden, der immer von einer Sigma -Verbindung begleitet wird (in Doppelbindungen).

In ähnlicher Weise können Sie eine dreifache Verbindung zwischen zwei benachbarten Atomen herstellen, die durch zwei PI -Bindungen in Positionen gebildet werden, die senkrechte Ebenen miteinander bilden, und eine Sigma -Verbindung zwischen den beiden Atomen.
Kann Ihnen dienen: Huminsäure: Struktur, Eigenschaften, erhalten, verwendet, verwendetBeispiele für PI -Links
Ethylenmolekül
Wie bereits erwähnt, haben die Moleküle, die von United -Atomen von einem oder mehreren PI -Bindungen bestehen, immer mehrere Links; Das heißt, doppelt oder dreifach.
Ein Beispiel hierfür ist das Ethylenmolekül (h2C = Ch2), die aus einer Doppelvereinigung bestehen; Das heißt, ein PI und eine Sigma -Bindung zwischen seinen Kohlenstoffatomen, zusätzlich zu den Sigma -Bindungen zwischen Kohlenstoffen und Wasserstoffen.
Acetylenmolekül
Das Acetylenmolekül (H-Cwerb-H) hat ein dreifacher Zusammenhang zwischen seinen Kohlenstoffatomen; Das heißt.
Benzol und Derivate
PI -Bindungen zwischen zyklischen Molekülen werden ebenfalls vorgestellt, wie Benzol (C)6H6) und seine Derivate, deren Disposition zu einem Effekt führt, der als Resonanz bezeichnet wird und der es ermöglicht, die elektronische Dichte zwischen Atomen zu wandern und unter anderem die Stabilität der Verbindung zu gewähren.
Dicarbon
Um die zuvor erwähnten Ausnahmen zu veranschaulichen, die Fälle des Dicarbonal -Moleküls (C = C, in dem beide Atome ein Paar gepaarter Elektronen aufweisen) und die Koordinationsverbindung, die als Hexacarbonildihierro bezeichnet wird (dargestellt als Glaube2(CO)6, die nur durch PI -Verbindungen zwischen seinen Atomen gebildet wird).

