Wasserstoffbrückenverbindung
- 4498
- 1162
- Lewis Holzner
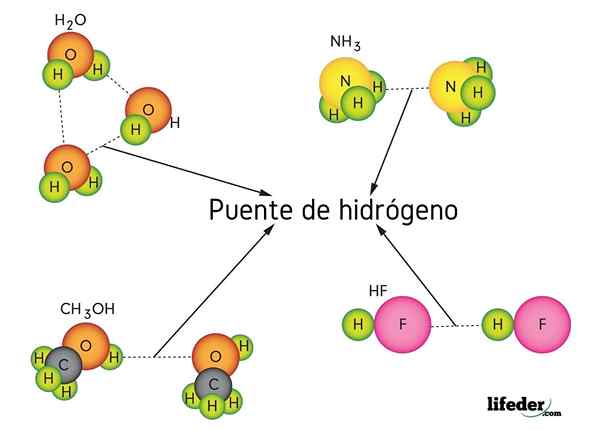
 Wasserstoffbrücke in Wasser (h)2O), Methanol (Cho3OH), Wasserstofffluorid (HF) und Ammoniak (NH3)
Wasserstoffbrücke in Wasser (h)2O), Methanol (Cho3OH), Wasserstofffluorid (HF) und Ammoniak (NH3) Was ist eine Wasserstoffbrückenverbindung?
Die Wasserstoffbrückenbindung ist eine spezielle Art der Dipol-Dipolo. Es gibt keine Rede von einem Elektronenfach, sondern von einem hauptsächlich elektrostatischen Phänomen.
Wie der Name schon sagt, wirkt Wasserstoff als Brücke, daher muss sie zwischen zwei Atomen liegen. Wasserstoff ist mit einem sehr elektronegativen Atom (wie N, O und F) verbunden (H-X) und nähert sich einem anderen elektronegativen Atom, aber aus einem benachbarten Molekül. Dies führt zur Bildung der Wasserstoffbrücke x ··· H-X.
Beachten. Schauen wir uns die Wasserstoffbrücke zwischen zwei Wassermolekülen an, wobei x das Sauerstoffatom ist: H2Oder ··· H-oh (unteres Bild).
Im Bild oben sehen wir, dass sieben Wassermoleküle dank ihrer Wasserstoffbrücken zusammen verbleiben, die durch blaue Linien dargestellt werden. Eine Wasserstoffbrücke allein ist nicht sehr stark, aber wenn es Milliarden von ihnen gibt, geben sie die Angelegenheit abnormale und unerwartete Eigenschaften.
Eigenschaften der Wasserstoffbrücke
Kompositional
Die Wasserstoffbrücke sollte wirklich als X '··· H-X dargestellt werden, wobei X als der Wasserstoffbrückenspender bezeichnet wird, da sie kovalent mit Wasserstoff verbunden ist (sie gibt sie).
In der Zwischenzeit ist X 'der Akzeptor der Wasserstoffbrücke, der in einem benachbarten Molekül vorhanden ist (erhält sie). Somit haben wir ein Donoratom (x), einen Wasserstoff (H) und ein Akzeptoratom (x '), das die Wasserstoffbrücke (x' ··· h-x) zusammenfasst, zusammenfasst.
Geometrisch
Wenn wir an eine Brücke denken, kommen uns flache oder gewölbte Oberflächen in den Sinn. Da angenommen wird, dass sich die Verbindungen nicht krümmen, haben wir zwei Entfernungen: x ··· H und H-X, die die Wasserstoffbrücke x ··· h-x bilden.
Kann Ihnen dienen: Irreversible Reaktion: Merkmale und BeispieleZwischen diesen beiden Entfernungen liegt ein Winkel, der oft 180 ° beträgt; Das heißt, die drei Atome unserer Brücke ruhen auf derselben horizontalen (oder vertikalen) Linie.
Wenn sich der Winkel von 180 ° unterscheidet, ist die x ··· H-X-Brücke nicht mehr gerade oder linear, sondern erhält andere Geometrien.
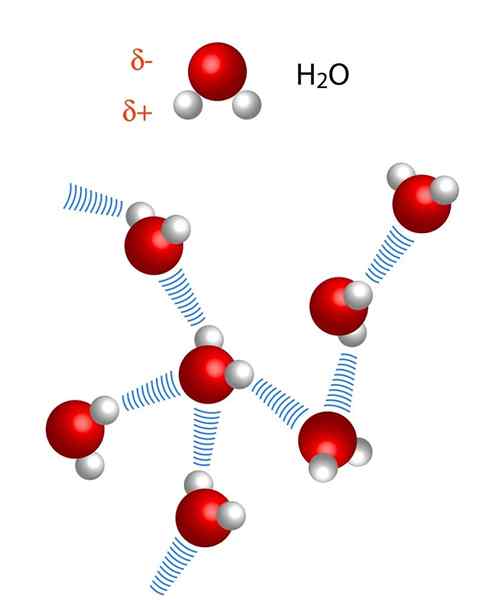
Andererseits sind Entfernungen in Wasserstoffbrücken nicht identisch. Der H-X-Abstand ist kürzer als x ··· h, was im Bild von Wassermolekülen zu sehen ist. So beträgt der H-X-Abstand beispielsweise normalerweise 110 Uhr (1 · 10)-12m), während die andere Entfernung x ··· h um 160 Uhr beträgt.
Assoziativ
Ein besonderes Merkmal der Wasserstoffbrücke ist, dass die Moleküle viel mehr miteinander verbunden sind. Sie gehen nicht von Seite zum anderen und ignorieren sich gegenseitig. Daher stellt es eine momentane Ordnung in den Brüsten von Flüssigkeiten fest; Und im Falle von Festkörpern tragen sie zur Definition ihrer Kristalle bei.
Wenn wir eine Wasserstoffbrücke sehen.
Energie
Eine Wasserstoffbrücke zu brechen ist nicht sehr schwierig. Wassermoleküle zum Beispiel gehen und kreieren Sie jedes Mal beim Mobilisieren. Aber viele von ihnen gleichzeitig würden implizieren, eine endlose Anzahl von Molekülen zu stören. Wir sprechen über die Versorgung einer solchen Energie, die Mol dieser Wasserstoffbrücken bricht (6.02 · 1023 X ··· H-X).
Somit variiert die Kraft der Wasserstoffbrücke in Abhängigkeit von der Identität und Art der Moleküle. Beispiel.
Kann Ihnen dienen: Chemische Veränderungen: Merkmale, Beispiele, TypenBeispiele für Wasserstoffbrücken
Wasser
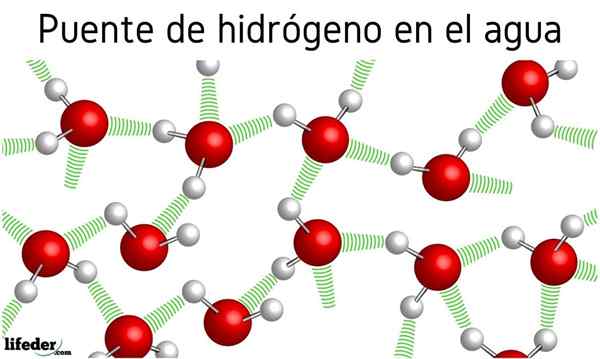
Zuerst war die Rede von Wasserstoffbrücken zwischen den Wassermolekülen, aber die Wirkung auf ihre Eigenschaften wurde nicht erwähnt. Dank ihnen kocht das Wasser bei 100 ° C und lässt die Siedepunkte verwandter Moleküle wie h2S, das kocht bei -60 ºC; oder h2Ich weiß, kochen bei -41.25 ºC.
Diese abgründige Differenz ist auf Wasserstoffbrücken zurückzuführen, die auch andere ihrer anomalen Eigenschaften wie ihre enormen spezifischen Wärme, Eiskristalle, ihre dielektrische Konstante usw. definieren.
Ethanol
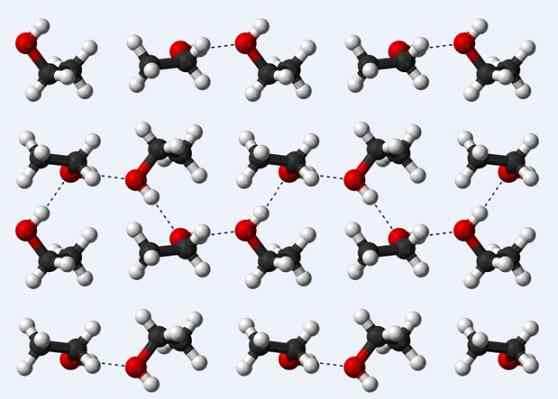 Wasserstoffbrücken in einem Ethanolkristall
Wasserstoffbrücken in einem Ethanolkristall Lassen Sie uns nun eine andere Wasserstoffbrücke sehen: die zwischen Ethanolmolekülen, CH3CH2Oh (oben). Beachten Sie, wie die Moleküle untergebracht sind3CH2Oh, so, dass ihre Wasserstoffbrücken hergestellt werden3CH2Ho ··· Hoch2CH3 (gepunktete Linien).
Die Moleküle sind jedoch zu beauftragt, über flüssige Ethanol zu sprechen, sondern aus einem Glas (fester Ethanol) ausmachen, sondern über ein flüssiges Ethanol ausmachen (solide Ethanol).
Die für Ethanol beschriebene Wasserstoffbrücke ähnelt der der anderen Alkohole, mit dem Unterschied, dass ihre kohlensäurehaltigen Skelette die Effizienz dieser Brücken behindern können.
Essigsäure
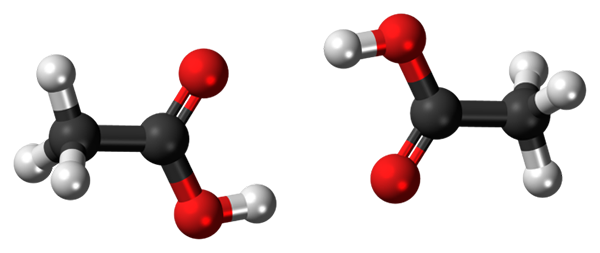 Wasserstoffbrücken zwischen zwei Essigsäuremolekülen. Quelle: Jynto, CC0, über Wikimedia Commons
Wasserstoffbrücken zwischen zwei Essigsäuremolekülen. Quelle: Jynto, CC0, über Wikimedia Commons Essigsäure, Cho3COOH ist in der Lage, zwei Wasserstoffbrücken zu etablieren, die zwei Moleküle gleichzeitig vereinen. Da es sich um zwei Moleküle handelt, die von den Wasserstoffbrücken verbunden sind, sprechen wir über ein Dimer.
Beachten Sie, dass eine dieser Wasserstoffbrücken c = o ··· h-o und der andere o-h ··· o = c ist. Essigsäure zeigt die Besonderheit, die in der Dampfphase wie dieses Dimer existiert.
Es kann Ihnen dienen: Mangan- oder PermangansäureZellulose
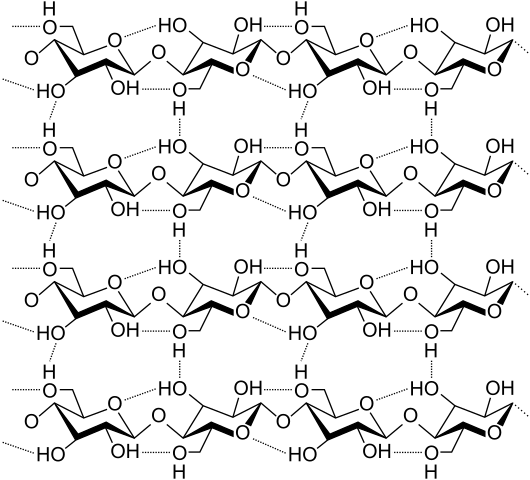 Wasserstoffbrücken zwischen mehreren Celluloseketten. Quelle: Laghi.L, CC BY-SA 3.0, über Wikimedia Commons
Wasserstoffbrücken zwischen mehreren Celluloseketten. Quelle: Laghi.L, CC BY-SA 3.0, über Wikimedia Commons Lassen Sie uns nun vielfältigere und mehrere Wasserstoffbrücken sehen. Cellulose, ein natürliches Polymer, besteht aus Ketten, die aus mehreren Einheiten von β-Glucose bestehen.
Jede Kette bleibt dank vielen Wasserstoffbrücken (überlegenes Bild) an einer anderen festgelegt, die den Zusammenhalt zwischen den Ketten verstärken.
DNA
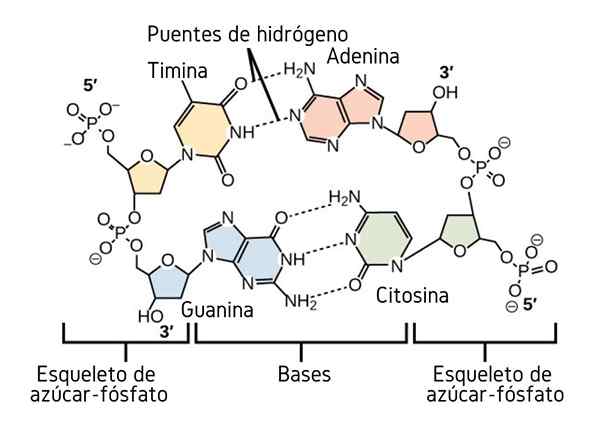 Wasserstoffbrücken zwischen den Stickstoffbasen von DNA. Quelle: CNX OpenStax, CC von 4.0, über Wikimedia Commons
Wasserstoffbrücken zwischen den Stickstoffbasen von DNA. Quelle: CNX OpenStax, CC von 4.0, über Wikimedia Commons Bisher haben wir die assoziative Wirkung von Wasserstoffbrücken gesehen, um die Ordnung zwischen den Molekülen aufzuerlegen. Aber was ist mit einem Makromolekül? In einem Makromolekül wie DNA finden wir interne oder intramolekulare Wasserstoffbrücken zwischen Thymin, Adenin, Guanin und Cytosin (oben) (oben) (oben).
Intramolekulare Wasserstoffbrücken zwischen diesen Stickstoffbasenpaaren und lassen das DNA -Molekül eine doppelte Propellerstruktur erwerben, die ideal für seine Replikation ist. Wenn diese Wasserstoffbrücken durch Erhitzen gebrochen werden, öffnet sich der Doppelpropeller in zwei einzelnen Segmenten oder Bändern.
Verweise
- Whitten, Davis, Peck & Stanley. (2008). Chemie. (8. Aufl.). Cengage Lernen.
- Shiver & Atkins. (2008). Anorganische Chemie. (Vierte Edition). Mc Graw Hill.
- Edward e. Ávila & Asilé J. Brombeere. (2004). Die Wasserstoffbrücke und ihre Anwendungen verknüpfen. Universität von Los Andes, Fakultät für Wissenschaften, Abteilung für Chemie.
- Wikipedia. (2020). Wasserstoffverbindung. Abgerufen von: in.Wikipedia.Org
- Pietri j. & Clark J. (21. August 2020). Wasserstoffbrückenbindung. Chemistry Librettexts. Erholt von: Chem.Librettexts.Org
- Die Herausgeber von Enyclopaedia Britannica. (2020). Wasserstoffbrückenbindung. Erholt von: Britannica.com
- Helmestine, Anne Marie, ph.D. (29. Oktober 2020). Was ist Beispiel für Wasserstoffbrückenbindung? Erholt von: thoughtco.com

