Chemische Bindung
- 2718
- 141
- Tizian Liebich
Wir erklären, was die chemischen Links sind, welche Typen existieren, und wir geben viele Beispiele an
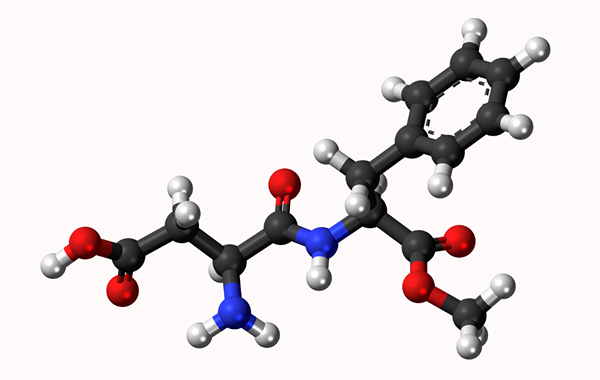
 Molekularmodell Aspartamo: Einfache Verbindung, die durch eine Linie und eine Doppelbindung durch zwei Linien dargestellt wird. Die Bälle sind Atome
Molekularmodell Aspartamo: Einfache Verbindung, die durch eine Linie und eine Doppelbindung durch zwei Linien dargestellt wird. Die Bälle sind Atome Was ist eine chemische Bindung?
A Chemische Bindung Es ist die Kraft, die zusammen mit den Atomen einer Verbindung zusammenhält. Die Kraft, die Atome vereint, ist elektromagnetisch, und wenn die Atome gebunden sind, behalten sie ihre eigene Natur bei.
Zum Beispiel wird aufgrund der Vereinigung von zwei Wasserstoffatomen (H) gemeinsames Wasser gebildet2) und einer von Sauerstoff (o); Deshalb ist seine chemische Formel H2ENTWEDER. Obwohl sie mit Wasser vereint sind, bleiben Wasserstoffatome Wasserstoff und Sauerstoff ist immer noch Sauerstoff.
Denken Sie daran, dass Atome durch einen Kern gebildet werden, der von einer Elektronenwolke umgeben ist, die eine negative Belastung aufweisen. Der Kern des Atoms hat eine positive Ladung, die es schafft, Elektronen anzuziehen.
Elektronen werden jedoch auch von den Kernen anderer Atome angezogen. So werden chemische Verbindungen gebildet. Die Tatsache, dass Atome Elektronen ergeben oder teilen, erzeugt die verschiedenen Arten von chemischen Verbindungen.
In chemischen Bindungen ergeben, gewinnen oder teilen Sie Elektronen der sogenannten Valencia -Schicht, die äußerste Schicht eines Atoms, bei dem Reaktivität auftritt, oder die Tendenz zur Bildung chemischer Bindungen.
Diese Links machen neue Substanzen (keine Gemische), die nicht durch Techniken wie Sieb oder Filterung getrennt werden können.
Chemische Bindungsarten
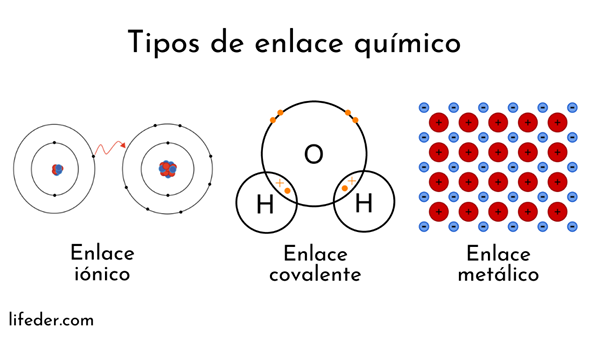
Atome werden durch einen Kern (mit positiver elektrischer Ladung) und Elektronen (Partikel mit negativer elektrischer Ladung) gebildet, um. Beide Parteien gehen in chemische Bindungen ein.
Chemische Bindungen mit Atomkern werden als metallisch bezeichnet. Andererseits sind diejenigen, die den Elektronenaustausch betreffen.
Kann Ihnen dienen: Chlobenzol (C6H5cl)Ionische Verbindungen
Diese Art von Verbindung ist sehr resistent; erzeugt feste chemische Verbindungen (Kristalle) im Wasser und mit einem hohen Schmelzpunkt (zwischen 300 und 1.000 Grad Celsius). In Wasser gelöst und sind Stromleiter.
Wie sind ionische Links?

Ionenbindungen treten zwischen einem Metall und einem Nicht -Metall auf, das eine unterschiedliche Elektronegativität aufweist (Fähigkeit, Elektronen anzuziehen). Die Elektronen der Valencia -Schicht eines Atoms zum anderen Atom von Valencia. Das ist das gleiche; Ein metallisches Atom verleiht einem nicht -metallischen Atom ein Elektron, das elektronische Stabilität erreicht.
Während des gesamten Linkbildungsprozesses (Kationen und Anionen) werden gebildet, daher der ionische Bindungsname.
Ein Beispiel für diese Art von Bindung ist Natriumchlorid: Diese chemische Verbindung wird gebildet, wenn Chlor (CL) das Elektron der Valenzschicht mit dem Natriumatom (Na) anzieht.
Ein weiteres Beispiel ist Manganchlorid (MGC), das zur Herstellung von Gemälden und Desinfektionsmitteln verwendet wird. Infolge der chemischen Bindung werden die Elektronen des Mangansatoms vom Chloratom absorbiert.
Kovalente Links
Die kovalenten Bindungen sind sehr hart und erzeugen unlösliche chemische Verbindungen mit einer hohen Fusionstemperatur (mehr als 1.000 Grad Celsius). Sie leiten keinen Strom.
Nach der Art und Weise, wie Atome ihre Elektronen teilen, können kovalente Bindungen:
- Einfach: Sie teilen ein paar Elektronen (A-A).
- Doppelt: Teilen Sie zwei Elektronenpaare (a =).
- Verdreifachen: Teilen Sie drei Elektronenpaare (A≡A).
Wie bilden sich kovalente Bindungen??

Die kovalente Bindung wird gebildet, wenn zwei nicht -metallische Elemente Elektronen ihrer Valenzschicht teilen.
Es kann Ihnen dienen: Rubidio: Geschichte, Eigenschaften, Struktur, Erhalten, VerwendungenDer Austausch von Elektronen erfolgt immer so, dass es dem Oktettgesetz entspricht. Dies ist ein chemisches Prinzip, das besagt, dass die stabilste Konfiguration für ein Atom eine ist, in der es acht Elektronen in seiner äußersten Schicht hat.
Ein Beispiel für kovalente Bindung ist Wasser (h2ENTWEDER). Um das Wassermolekül zu schaffen, werden zwei einfache kovalente Bindungen benötigt. In einer einfachen Bindung wird das Wasserstoffelektron mit Sauerstoff geteilt, und Sauerstoff hat ein Elektron mit Wasserstoff.
Ein weiteres Beispiel für kovalente Bindungen ist Kohlendioxid (CO2) eine der wichtigsten Verantwortlichen für den Gewächshauseffekt und den Klimawandel. Um diese Verbindung zu bilden, erzeugen Kohlenstoff und Sauerstoff zwei Doppelbindungen, dh für jeden Glied zwei Elektronenpaare teilen.
Metallverbindungen
Diese Art von Link geschieht nur in Metallelementen. Es besteht aus der Vereinigung der Kerne zweier Atome desselben metallischen Elements zusammen mit ihren Elektronen.
Metallverbindungen sind durch wirksame Elektrizitätsleiter, einen sehr hohen Fusion- und Siedepunkt und leicht oxidiert. Sie sind auch formbar und resistent gegen Kratzer, sehr fest und stark.
Wie sind Metalllinks?
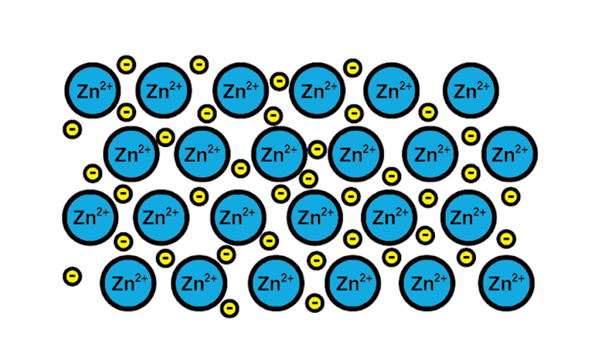 Zink Metallic Link
Zink Metallic Link Ein Beispiel für eine metallische Verbindung ist das von Zink, ein metallisches Element. Der Trainingsprozess dieser Art von Link ist:
1-A Atomkern eines metallischen Elements trifft auf einen anderen Kern desselben Elements.
2-Die Elektronen der Valencia-Schicht beider Kerne werden zu einem Elektronenmeer herum. Das heißt, sie umkreisen keinen einzigen Atomkern.
3-Die positiven Lasten der Atomkerne und die Negative der Elektronen werden angezogen. Das Ergebnis sind Valenzelektronen, die das Meer der Elektronen um die Atomkerne bilden (Kationen).
Es kann Ihnen dienen: Kupfersulfat (CUSO4): Struktur, Eigenschaften, erhalten, verwendet, verwendetBeispiele für chemische Bindungen
Ionische Verbindungen
- Bariumoxid (BAO).
- Magnesiumchlorid (MGCL2).
- Calciumoxid (CAO)
- Silbernitrat (Agno3)
- Zinkhydroxid (Znoh2)
- Kaliumbromid (KBR)
- Calciumcarbonat (Caco3)
- Kupfersulfat (Cuo4)
- Lithiumfluorid (LIF)
- Manganchlorid (MNCL2)
- Kaliumsulfat (k)2SW4)
- Eisenoxid (hässlich)
- Dinatriumphosphat (NA)2HPO4)
- Kalium Ioduro (Ki)
Kovalente Links
- Kohlendioxid (CO2)
- Ammoniak (NH3)
- Paraffin (CNH2N+2)
- Diesel (c12H26)
- Dibromo (Br2)
- Kohlenmonoxid (CO)
- Butano (c4H10)
- Benzol (c6H6)
- Molekularer Stickstoff (n2)
- Methan (Ch4)
- Salzsäure (HCL)
- Cyanhydsäure (HCN)
Metallverbindungen
Jedes Metall in seinem reinen Zustand ist ein Beispiel für eine metallische Verbindung, nämlich:
- Nickel (Ni)
- Eisen (Glaube)
- Aluminium (Al)
- Titan (Ti)
- Blei (PB)
- Kobalt (CO)
- Kupfer (Cu)
- Zink (Zn)
- Quecksilber (HG)
- Gold (Au)
- Silber (AG)
- Barium (BA)
Bedeutung chemischer Bindungen
Die Bedeutung chemischer Bindungen ist, dass sie organische und anorganische Moleküle bilden und auf diese Weise Teil der Basis aller lebenden Organismen sind. Wenn sie bestimmten Bedingungen ausgesetzt sind, können diese Links gebrochen werden. Diese Energie wird genannt Verknüpfungsenergie.
Einige der Techniken zum Brechen der Verbindungen werden durch Elektrizität, hohe Temperaturen oder provozierende chemische Reaktionen mit verschiedenen Verbindungen angewendet.
Zum Beispiel um Sauerstoff- und Wasserstoffmoleküle von H zu trennen2Oder wir können Strom auf das Wasser anwenden, was als Elektrolyse bezeichnet wird.
Die durch Link gebildeten chemischen Verbindungen sind zahlreich und sind im Alltag vorhanden. Das Salz, mit dem wir Lebensmittel würzen, ist ein chemisches Verbindungsprodukt des Zusammenhangs zwischen einem Natrium (Na) und einem Chlor (CL) Atom (CL). Seine chemische Formel ist NaCl, das Natriumchlorid liest.

