Enthalpía
- 1627
- 150
- Luca Holdt
Was ist Enthalpie?
Der Enthalpía Es handelt sich um eine thermodynamische Eigenschaft. Als Zustandsfunktion wird sie mit dem Buchstaben in Kapital H dargestellt, da es sich um eine Variation handelt.
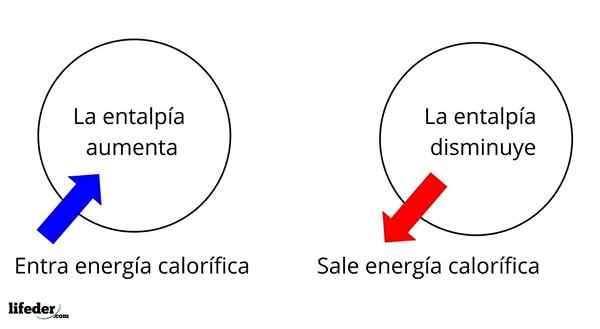
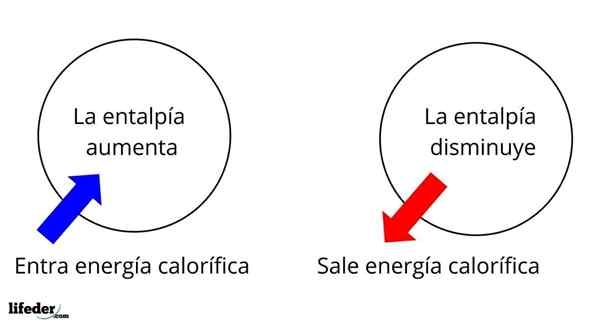
Es ist eine der grundlegendsten Eigenschaften, um die Thermochemie vieler Reaktionen zu untersuchen. Das heißt, wir sprechen über die Ablösung oder Absorption der Wärme zwischen dem Reaktionsmedium und seiner Umgebung. Wir sagen daher, dass eine Reaktion exotherm ist, wenn ihre ΔH negativ ist (ΔH 0).
 Die Änderung der Enthalpie beim Schmelzen des Eises ist positiv, was darauf hinweist
Die Änderung der Enthalpie beim Schmelzen des Eises ist positiv, was darauf hinweist Eis zum Beispiel hat eine Enthalpie, hEis, Während Wasser auch eine eigene Enthalpie hat, hWasser. Wenn das Eis schmilzt, tritt eine Enthalpievariation auf, die als ΔH bezeichnet wirdFus oder schmelzende Hitze (hWasser-HEis). Wasserenthalpie ist Eis überlegen und verursacht ΔHFus Für das Eis ist positiv und einen Wert von +6.01 kJ/mol.
Enthalpie und seine Variation werden normalerweise in Joule oder Kalorieneinheiten ausgedrückt. Die Änderung der Enthalpie +6.01 kJ/mol zeigt an, dass ein Eismol 6 absorbieren muss.01 kJ Kalorienergie oder Wärme zum Schmelzen.
Wie wird Enthalpien berechnet??
Enthalpie und seine Variation
Enthalpie selbst ist unkalkulierbar, da es von Variablen abhängt, die schwer genau zu messen sind. Ein guter Vergleich wäre, das Gesamtvolumen der Ozeane zu messen: Es wird immer Teile davon unter der Erde geben oder zwischen den Kontinenten verstreut sind. Daher und in der Praxis kann H nicht bestimmt werden; Aber ja ΔH.
Kann Ihnen dienen: KolloidUm einen mathematischen Ausdruck zu erreichen, der die Berechnung von ΔH ermöglicht, muss es zunächst von der grundlegenden Definition von Enthalpie übrig sein:
H = U + PV
Die interne Energie des Systems oder die fragliche Substanz und PV der Druck-Volumen-Arbeit, die dieses System auf die Umgebung ausübt, um zu existieren. Da wir an der Berechnung von ΔH und ohne H interessiert sind, haben wir:
ΔH = ΔU + δ (PV)
Wenn der Druck konstant ist, bleibt die Gleichung:
ΔH = ΔU + PδV
Wir wissen andererseits das:
ΔU = Q + W
Sein Q Wärme und W -Arbeit. Uns ersetzen:
ΔH = Q + W + pδv
Aber außerdem wissen wir das:
W = - pδv
Und deshalb:
ΔH = Q - Pδv + PδV
ΔH = Q
Das heißt, das ΔH für eine Reaktion oder einen Prozess, das unter konstantem Druck durchgeführt wird, ist gleich der Hitze Q erzeugt oder absorbiert.
Reaktionen enthalpy ändert sich
Die Annahme, dass der Druck konstant bleibt, ist möglich, wenn die Reaktion unter der Erdatmosphäre auftritt. Zum Beispiel schmilzt das Eis der Winterlandschaften ohne einen weiteren Druck als das unserer Atmosphäre. Andererseits gilt es auch für Reaktionen in flüssigen Medien oder für solche, die keine großen Mengen an Gasen produzieren.
Diese Reaktionen absorbieren oder füllen Wärme ab Q Gleich wie ΔH, was wiederum der Unterschied in den Enthalpien zwischen Produkten und Reaktanten ist:
ΔH = hProdukte - HReaktanten
Arten von Enthalpie
Es ist eine übliche Praxis, über ΔH und H zu sprechen, als ob sie gleich wären: Beide werden als Enthalpien bezeichnet. Wenn es jedoch um die Typen geht, ist H für jede Substanz oder jedes System einzigartig. Während ΔH andererseits der Art der Reaktion oder des Prozesses an sich unterliegt.
In diesem Sinne haben wir zunächst positive Enthalpievariationen (ΔH> 0) oder negativ (ΔH <0); unas corresponden a los procesos o reacciones endotérmicos (se enfrían los alrededores), mientras las segundas tienen que ver con los procesos o reacciones exotérmicos (se calientan los alrededores).
Es kann Ihnen dienen: Nitrobenzol (C6H5N2): Struktur, Eigenschaften, Verwendungen, RisikenDas Vorzeichen '+' oder '-', das uns begleitet, sagt uns daher, wenn es in einer bestimmten Reaktion oder eines bestimmten Prozesses Befreiung oder Absorption von Wärme gibt; die ihre ΔH -Eigenschaften als Teil ihrer thermochemischen Eigenschaften haben.
Wir haben Unendlichkeiten von Enthalpienarten, die nach physikalischen Prozessen oder chemischen Reaktionen klassifiziert werden können.
Physische Prozesse
Phasenänderung Enthalpie
Substanzen müssen Wärme absorbieren oder freisetzen, um sich von einer Material- oder Materialphase (Feststoff, Flüssigkeit oder Gas) zu einem anderen zu bewegen. Zum Beispiel absorbiert Eis Wärme zum Schmelzen, so dass Enthalpie für diese Phasenänderung der Fusion entspricht, ΔHFus, Auch als latente Wärme bezeichnet.
Enthalpie der Auflösung oder Mischung
Substanzen, wenn sie gelöst oder in einem Lösungsmittelmedium gemischt werden, können Wärme absorbieren oder freisetzen und so eine Enthalpie ΔH habenDis oder ΔHMischen.
Chemische Reaktionen
Ausbildung Enthalpie
Es ist die zugehörige Wärme, ΔHºF, zur Bildung einer Verbindung, insbesondere eines Maulwurfs, von seinen Bestandteilen unter Standardbedingungen des Drucks und der Temperatur (t = 298.15 K und p = 1 atm).
Zersetzung Enthalpie
Es ist die zugehörige Hitze, ΔHDes, zum Abbau einer Verbindung in kleineren und einfachen Substanzen. Es ist im Allgemeinen positiv, weil Wärme benötigt wird, um die Bindungen der Moleküle zu brechen.
Hydrierungenthalpie
Es ist die zugehörige Hitze, ΔHH, Zur Sucht eines Wasserstoffmoleküls zu einer Verbindung, normalerweise eines Kohlenwasserstoffs.
Verbrennung Enthalpie
Es ist die Wärme freigesetzt, ΔHKamm, Wenn eine Substanz brennt, die mit Sauerstoff reagiert. Es ist negativ, weil Wärme und Licht freigesetzt werden (Feuer).
Es kann Ihnen dienen: Atommasse: Definition, Typen, wie man sie berechnet, BeispieleBeispiele für Enthalpien
Schließlich werden einige spezifische Beispiele für Enthalpien erwähnt:
Methanverbrennung
CH4 + 22 → co2 + 2H2ENTWEDER
ΔH = -890.3 kJ/mol
Das heißt ein Mol Cho4 Wenn die Verbrennung 890 befreit.3 kJ Kalorienenergie.
Hydrierung von Ethylen
CH2= Ch2 + H2 → Ch3CH3
ΔH = -136 kJ/mol
Ein Mol Ethylen freisetzt 136 kJ Wärme, wenn Wasserstoff ein Ethan wird.
Salz in Wasser
Tischsalz, NaCl, löst sich im Wasser auf, um die NA -Ionen zu trennen+ und Cl- von kristallinen Netzwerken und Umgebung (Hydrat) von Wassermolekülen:
NaCl (s) → Na+(Ac) + cl-(Ac)
ΔH = +3.87 kJ/mol
Das heißt, das Salz in Wasser auflösen, entsprechend, um das Glas oder den Behälter abzukühlen. Die absorbierte Wärmemenge ist jedoch sehr klein, sodass unsere Hände nur eine leichte Temperaturänderung verspüren.
Kaliumchloratauflösung im Wasser
Andererseits das Kaliumchlorat KCLO3, Es hat ein ΔHDis sehr positiv:
Kcl3(s) → k+(ac) + clo3-(Ac)
ΔH = +41.38 kJ/mol
Was bedeutet, dass es sehr heiß ist, sich im Wasser aufzulösen. Und deshalb wird der Behälter erheblich abkühlen, und wir werden sehen, dass der umgebende Wasserdampf seine äußere Oberfläche befeuert wird.
Verweise
- Whitten, Davis, Peck & Stanley. (2008). Chemie. (8. Aufl.). Cengage Lernen.
- Wikipedia. (2020). Enthalpie. Abgerufen von: in.Wikipedia.Org
- Helmestine, Anne Marie, ph.D. (28. August 2020). Enthalpie -Definition in Chemie und Physik. Erholt von: thoughtco.com
- Andrew Rader Studios. (2015). Energie und Enthalpie. Erholt von: Physics4Kids.com
- Kiddle. (2020). Enthalpie Fakten für Kinder. Abgerufen von: Fakten.Kiddle.CO
- Administrator. (21. Dezember 2010). Die Enthalpie. Erholt von: Oxyorganische Chemikalie.com
- María Estela Raffino. (11. Juli 2020). Entalpia -Konzept. Erholt von: Konzept.von

