Epmers
- 4450
- 1121
- Lewis Holzner
 Struktur eines Epimers. Quelle: Gabriel Bolívar
Struktur eines Epimers. Quelle: Gabriel Bolívar Was sind die Epigrafts??
Der Epmers Sie sind Diaiaisomere, in denen sich nur einer seiner aquiralen Zentren von der räumlichen Konfiguration unterscheidet, im Gegensatz zu Enantiomeren, in denen alle aquiralen Zentren unterschiedliche Konfigurationen haben und einige Spiegelbilder darstellen, die sich nicht übereinander überlappen können.
Der Rest der Diastasters (z. B. geometrische Isomere) kann mehr als zwei Zentren mit unterschiedlichen Konfigurationen haben. Daher sind ein großer Prozentsatz der Stereoisomere Diastoisomere.
Epmers treten häufig in Kohlenhydraten auf: Beispielsweise unterscheiden sich D-Glycose und D-Manosa in C2, dem ersten chiralen Kohlenstoffatom.
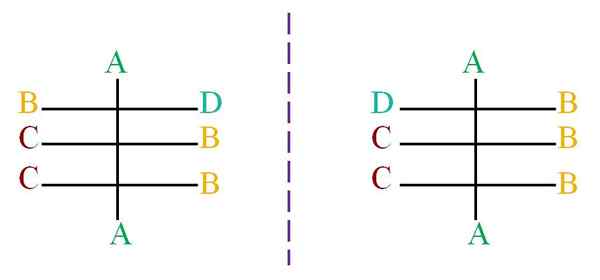
Nehmen wir eine Struktur mit einem Skelett schwarzer Atome an, das mit den Buchstaben A, B, C und D verbunden ist (überlegenes Bild).
Die gepunktete Linie repräsentiert den Spiegel und zeigt, dass das Drehmoment der oben genannten Moleküle keine Enantiomere ist, da alle seine chiralen Zentren die gleiche Konfiguration haben, mit Ausnahme des ersten Zentrums, das mit den Buchstaben B und D verbunden ist.
Das Molekül links hat den Buchstaben D nach der rechten Seite, während der Buchstabe D des rechten Moleküls zur linken Seite schaut. Um zu wissen, was die Konfiguration jedes einzelnen an das System (R-S) von Cahn-Ingold-Prelog verwendet werden muss.
Eigenschaften der Epigmers
- Das Hauptmerkmal der Epigmers liegt nur in einem aquiralen Zentrum (oder stereogen).
Das Ändern der räumlichen Ausrichtung von D und B kann stabilere oder instabilere Konformere verursachen, dh die Drehungen der einfachen Verbindung führen zu zwei Atomen oder Gruppen von sperrigen Atomen.
Somit kann ein Epimer viel stabiler sein als das andere. Wer seine Links drehen.
Kann Ihnen dienen: inhomogenes SystemRückkehr zu Buchstaben, D und B können sehr sperrig sein, während C ein kleines Atom ist. Es ist also stabiler, das Epimer der rechten Seite zu sein, da D und C links von den ersten beiden Zentren unter weniger sterischen Hindernissen leiden.
- Mikroskopisch wird dies zu einem Merkmal für das in Betracht gezogene Epithelen.
- Makroskopisch sind die Unterschiede akzentuiert und beenden beispielsweise Schmelzpunkte, Brechungsindizes, verschiedene NMR -Spektren (zusätzlich zu vielen anderen Eigenschaften).
- Auf dem Gebiet der Biologie und Reaktionen, die durch Enzyme katalysiert werden. Einer könnte vom Körper metabolisiert werden, während der andere nicht tut.
Ausbildung
EPMERS werden durch eine chemische Reaktion gebildet, die als Epimerisierung bezeichnet wird. Wenn sich beide Inititaker nicht in einem hohen Grad an Stabilität unterscheiden, wird ein Gleichgewicht der Epimerisierung festgelegt, was nichts anderes als eine Interkonversion ist:
EPB EPA
Wo EPA Epimer A ist und das Epimer EPB. Wenn einer von ihnen viel stabiler ist als der andere, hat er eine größere Konzentration und verursacht das, was als Steuertarrotation bezeichnet wird. Mit anderen Worten, er wird in der Lage sein, die Richtung eines polarisierten Lichtstrahls zu verändern.
Die Epimerisierung ist möglicherweise kein Gleichgewicht und ist daher irreversibel. In diesen Fällen wird eine rankische Mischung aus EPA/EPB -Diaststeroisomeren erhalten.
Der synthetische Weg der Epitare variiert je nach den beteiligten Reagenzien, den Reaktionsmitteln und den Prozessvariablen (Verwendung von Katalysatoren, Druck, Temperatur usw.).
Aus diesem Grund muss die Bildung jedes Epitarenpaares einzeln von anderen untersucht werden, die jeweils ihre eigenen chemischen Mechanismen und Systeme haben.
Es kann Ihnen dienen: Reduktionsmittel: Konzept, die stärksten BeispieleTautomerisierung
Unter allen Epitemer -Bildungsprozessen kann zwei -Tag zwei -Tage -Tautomerisierung als allgemeines Beispiel betrachtet werden.
Dies besteht aus einem Gleichgewicht, in dem das Molekül eine Ketonform (C = O) oder den Enlicus (C-OH) annimmt. Sobald die ketonische Form umgestellt ist.
Ein Beispiel für das oben erwähnte ist das cis-Decalon- und Transdekalon-Drehmoment.
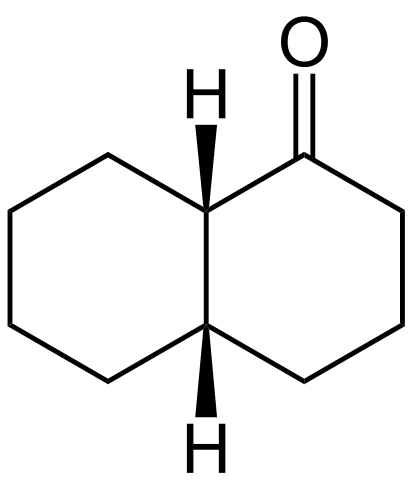 Cis-Decalona-Struktur. Quelle: Wikimedia Commons
Cis-Decalona-Struktur. Quelle: Wikimedia Commons Die Struktur der cis-Decalona ist oben gezeigt. H-Atome befinden sich oben auf den beiden Ringen, während im Transdekalon eine über den Ringen liegt und der andere unter.
Der Kohlenstoff links von Gruppe C = O ist das quirale Zentrum und daher derjenige, der die Epitch unterscheidet.
Beispiele
Glukoseanomere
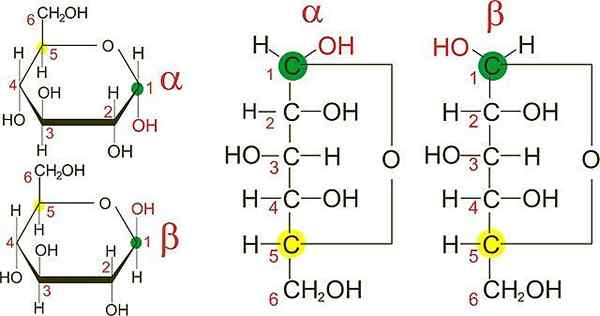 D-Glucose-Anomere. Quelle: Wikimedia Commons
D-Glucose-Anomere. Quelle: Wikimedia Commons In dem überlegenen Bild haben Sie die furanösen Ringe der beiden D-Glycose-Anomere: α und β. Aus den Ringen ist zu erkennen, dass die OH -Gruppen in Carbon 1 entweder in der gleichen Richtung des benachbarten OH im α -Anomer oder in entgegengesetzten Richtungen wie im β -Anomer gefunden werden.
Die Fisher -Projektionen beider Anomere (rechts vom Bild) machen den Unterschied zwischen beiden Epithemen noch klarer, die wiederum Anomere sind.
Zwei α -Anomere können jedoch unterschiedliche räumliche Konfigurationen in einem der anderen Kohlenstoffe und damit in Epithemen aufweisen.
In der C-1 der Fisher-Projektion für das α-Anomer sieht die OH-Gruppe nach rechts aus, während im β-β-β-Anomer "β" aussieht.
Kann Ihnen dienen: Faraday konstantMentolisomere
 Stereoisomere von Mentol. Quelle: Wikimedia Commons
Stereoisomere von Mentol. Quelle: Wikimedia Commons In dem Bild haben Sie alle Stereoisomere des Mentolmoleküls. Jede Spalte repräsentiert ein Paar Enantiomere (sorgfältig beobachten), während die Ränge den Diastereoisomeren entsprechen.
Die Epitare müssen also diejenigen sein, die kaum nur in der räumlichen Position eines Kohlenstoffs unterscheiden.
Das (+)-Mentol und das (-)-Neoisomentol sind epheres und auch Diabetereoisomere (sie sind nicht in derselben Spalte).
Wenn es im Detail beobachtet wird, in beiden Gruppen -oh und -ch3 Sie verlassen die Ebene (über dem Ring), aber im (-)-Neoisomentol weist die Isopropil-Gruppe auch aus der Ebene hin.
Nicht nur das (+)-Mentol ist das Epimer von (-)-Neoisomentol, sondern auch (+)-Neomentol. Letzteres unterscheidet sich nur, dass die Gruppe -ch3 zeigt das Flugzeug hinunter. Andere Epheres sind:
- (-)-Isomentol und (-)-Neomentol
- (+)-Isomentol und (+)-Neomentol
- (+)-Neoisomentol und (-)-Neomentol
- (+)-Neomentol und (-)-Neoisomentol
Diese Stereoisomere stellen ein praktisches Beispiel dar, um das Konzept von Epithemen zu klären, und es ist ersichtlich, dass viele von mehreren Diastereoisomeren nur in einem einzelnen asymmetrischen oder chiralen Kohlenstoff differenziert werden können.
Verweise
- Carey f. (2008). Organische Chemie. Mc Graw Hill.
- Epmers. Aus Klassenzimmern abgerufen.Uruguayeduca.Edu.Oh

