Flüssigkeitsdampfbalance

- 3289
- 589
- Medine Kedzierski
Was ist Flüssigkeits-Dampfbalance?
Er Flüssigkeitsdampfbalance Es handelt. Um den Behälter zu finden, muss geschlossen werden, sonst würden die Luftströmungen dazu führen.
Wenn das System geschlossen ist, wird der Druck durch Dampfphasenmoleküle mit der Zeit steigen. Ein Punkt wird kommen, wo der Druck aufhört; Dies ist der Dampfdruck der Flüssigkeit, der eine physikalische Eigenschaft der Materie ist und unabhängig von der Größe des Behälters oder des Flüssigkeitsvolumens ist.
 Wenn ein Gasgetränk freigelegt ist, wird sein Flüssigkeits-Dampf-Gleichgewicht gestört, was zu einem Ungleichgewicht des Drucks außerhalb und innerhalb der Flasche führt, und damit die Bubb. Quelle: OpenStax, CC von 4.0, über Wikimedia Commons
Wenn ein Gasgetränk freigelegt ist, wird sein Flüssigkeits-Dampf-Gleichgewicht gestört, was zu einem Ungleichgewicht des Drucks außerhalb und innerhalb der Flasche führt, und damit die Bubb. Quelle: OpenStax, CC von 4.0, über Wikimedia Commons Jede Flüssigkeit, rein oder gemischt, hat einen zugehörigen Dampfdruck, der von der Volatilität seiner Komponenten abhängt. Und deshalb von den intermolekularen Kräften, die sie in der Flüssigkeit und auf ihrer Oberfläche zusammenhalten.
Dieser Druck kann beschrieben werden, indem die Idealität der Lösungen oder die Mischbarkeit der Komponenten einer Mischung angenommen wird. Dazu ist die Verwendung von Binärdiagrammen sehr nützlich, bei denen es möglich ist, die Lebensfähigkeit eines Trennungsprozesses zu betrachten.
Das Gleichgewicht des Flüssigkeitsdampfes ist für die Unendlichkeiten von Chemieingenieurverfahren wie fraktionierte Destillationen und solche mit Wasserdampf, durch die destillierte Destillierte in den flüchtesten Komponenten erhalten wird, wesentlich. Dies ist der Fall von Ethanol bei 95.4% im Wasser, der der zugänglichste und wirtschaftlichste Alkoholprozentsatz auf dem Markt ist.
Reine Substanzen
Die Moleküle einer reinen Substanz sind nicht still, sondern wechseln Sie dank einer intrinsischen kinetischen Energie von einem Ort zum anderen. Diese Energie kann manchmal groß genug sein, um die intermolekularen Kräfte zu überwinden, die ein Molekül von Besonderem zum Busen der Flüssigkeit "ziehen". Dann entkommt das Molekül aus der Oberfläche der Flüssigkeit zur Dampfphase.
In der Dampfphase kollidieren die Moleküle mit den inneren Wänden des Behälter.
Kann Ihnen dienen: Kobalt: Struktur, Eigenschaften, AnwendungenDaher läuft die Zeit bis zu einer bestimmten Temperatur (um 25 ° C) zu einer bestimmten Anzahl von Molekülen, die der Oberfläche entkommen, denen, die aus Dampf eintreten. Es wird daher gesagt, dass in einer reinen Substanz ein Gleichgewicht zwischen Flüssigkeitsdampfen festgelegt wurde.
Der Dampfdruck, die inneren Wände des Behälters sowie die Oberfläche der Flüssigkeit zu erleben, ist gleich pZUº, der konstant und reproduzierbar ist; Unabhängig davon, wie groß oder klein der Behälter ist und das Volumen der Flüssigkeit zu berücksichtigen ist.
Mischungen
In flüssigen Gemischen gibt es auch eine Komponente, die Druck auf die flüssige Oberfläche und die Behälterkonturen ausübt. Ihr Dampfdruck wird, wie erwartet, aus Beiträgen aus jeder der Komponenten der Mischung bestehen, um zu sagen, zwei Substanzen A und B. Diese Gemische können mischbar und teilweise mischbar sein.
Mischbar
In einer mischbaren Mischung zwischen A und B bilden beide Substanzen eine ein Phase, die auf den ersten Blick wie eine reine Substanz aussieht. So entspricht der Druck der Mischung oder Lösung nach Daltonschen Gesetz:
PSonne = PZU + PB +··· PYo
PYo Jede andere Komponente, die auch in der Mischung vorhanden ist. Beachten Sie, dass pZU≠ pZUº, dh die Drücke der Substanzen in der Misch.
Bei der Annahme, dass die Lösung ideal ist, sind die Unterschiede zwischen den Interaktionen A-A, B-B und A-B offensichtlich. Dies kann beispielsweise in einer Mischung aus Ethanol und Methanol angewendet werden.
Daher hängen die Dampfdrücke der Komponenten in der Mischung von ihren relativen Mengen in der flüssigen Phase ab, ausgedrückt als Molfraktionen xYo. Und hier greift Raaults Gesetz ein, das versucht, den Druck p zu erzählenZU Und PZUº:
PZU = XZU PZUº
Jetzt ist der Gesamtdruck gleich:
PSonne = XZU PZUº + xB PBº +···
Die Dampfphase hingegen hat ihre eigenen Kompositionen, die als Yi -Molfaktionen ausgedrückt werden:
Yi = pYo / PSonne
= XYo PYoº / pSonne
Binärdiagramm
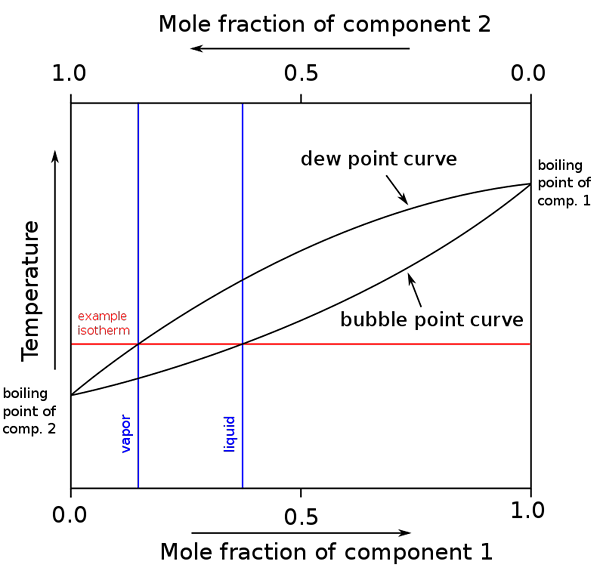 Diagramm von Siedepunkten und Molarenzusammensetzungen für eine binäre Mischung. Quelle: BINARY_BOILING_POINT_DIAGRAM.PNG: H Padleckasderivative Arbeit: Michbich, CC BY-SA 2.5, über Wikimedia Commons
Diagramm von Siedepunkten und Molarenzusammensetzungen für eine binäre Mischung. Quelle: BINARY_BOILING_POINT_DIAGRAM.PNG: H Padleckasderivative Arbeit: Michbich, CC BY-SA 2.5, über Wikimedia Commons Wenn die molaren Fraktionen der Komponenten eines Binärgemisches (a + b) je nach Temperatur oder Druck grafisch sind, werden Binärdiagramme erhalten (siehe oben). Diese besondere Form, die einfachste, entspricht der von idealen Lösungen.
Kann Ihnen dienen: Molienvolumen: Konzept und Formel, Berechnung und BeispieleDie Fläche über dem „Oval“ entspricht der Dampfphase, während der Bereich darunter der flüssigen Phase des Gemisches entspricht. Beachten Sie, dass wenn der Molfraktion von Komponente 1 oder 0 ist (x1= 0), der molare Teil der Komponente 2 oder B entspricht 1 (x2= 1), und dann schuldet der Dampfdruck nur B. Diese Temperatur wird zum Siedepunkt von B.
In der Zwischenzeit am anderen Ende (rechts), wenn x2= 0 Aber x1= 1 ist der Dampfdruck nur. Diese Temperatur wird die seines Siedepunkts.
Die untere ovale Linie entspricht dem Blasenpunkt, wenn die erste Blase erscheint, wenn das flüssige Gemisch erhitzt wird (das Diagramm hinaufgeht). Und die obere Linie entspricht dem Taupunkt, in dem die Dampfphase abkühlt und der erste Tropfen (im Diagramm nach unten) abkühlt).
Azeotropos
In vielen nicht idealen Lösungen werden wir Azeotrops haben, die Gemische sind, die ihre Zusammensetzung konstant aufrechterhalten. Das heißt, sie verdampfen, als wären sie eine reine Verbindung.
Es ist unmöglich, eine azeotrope Zusammensetzung durch mehr Destillationsschritte zu "brechen". Stattdessen werden andere Methoden verwendet, um die Reinheit der gewünschten Komponente zu erhöhen.
Zum Beispiel bildet die Ethanol-Wasser-Mischung ein Azeotrop mit einer 95-Zusammensetzung.4 von Ethanol. Dies bedeutet, dass es durch Destillationen unmöglich ist, ein Ethanol mit einer Konzentration von mehr als 95 zu erhalten.4%; Es wird immer 4 geben.6% verbleibendes Wasser. Wenn Sie absolutes Ethanol (100%) vorbereiten möchten, wäre es erforderlich, dehydrierende Materialien oder andere Syntheserouten zu verwenden.
In einem binären Diagramm können wir das Vorhandensein eines Azeotrops sehen, in dem die folgende Form vorgestellt wird:
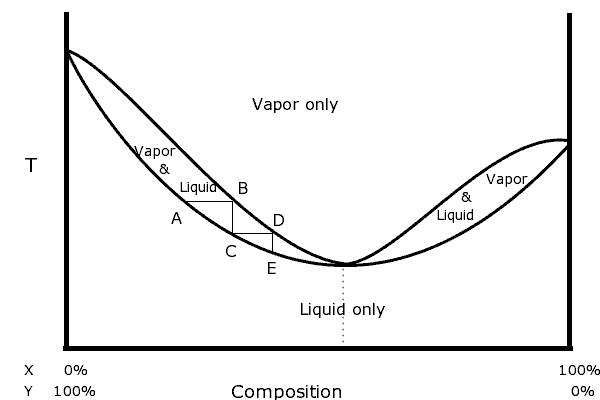 Binärdiagramm einer Mischung mit positivem Azeotrop. Quelle: Karlhahn in englischer Wikipedia, Public Domain, über Wikimedia Common
Binärdiagramm einer Mischung mit positivem Azeotrop. Quelle: Karlhahn in englischer Wikipedia, Public Domain, über Wikimedia Common Links vom Diagramm ist zu erkennen, dass wir innerhalb des „Ovals“, einem Bereich, in dem wir das Gleichgewicht zwischen Flüssigkeit und Dampf haben Mischung in der volatilsten Komponente (x für dieses Diagramm).
Im azeotropen Punkt ist die x und y und kochen Sie die Mischung, als wäre es eine einzelne Substanz, so.
Kann Ihnen dienen: Molekulare Formel: Wie man sie herausholt, Beispiele und ÜbungenTeilweise mischbar
In den teilweise mischbaren Gemischen, die sie je nach Temperatur gebildet werden, zwei erkennbare Phasen: eine reichhaltige Komponente A und ein anderer reich an Komponenten B. Die Binärdiagramme für diese Fälle sind viel strenger und breit, da sie Regionen umfassen, in denen Dampf zusammen mit den beiden Phasen zusammenfassen.
Nicht mischbar
Wenn sie über nicht mischbare Gemische sprechen, verhalten sich jede Komponente so, als ob sie in einem Zustand hoher Reinheit wäre, da sie kaum mit den anderen Molekülen interagiert. Daher ist der Dampfdruck für diese Gemische gleich:
PSonne = PZUº + pBº +··· pYoº
Die Mischung kocht bei einer Temperatur, die niedriger ist als die von reinen Komponenten, da der Druck des nicht mischbaren Gemisches höher ist, da es gleich der Summe der Drücke jeder Komponente in ihrem reinen Zustand ist. Mehr Dampfdruck impliziert, dass er flüchtiger ist und daher bei einer niedrigeren Temperatur kochen wird.
Anwendungen
Destillationen
In Destillationen, insbesondere auf industrieller Ebene. Aus den Komponenten der Mischung und in ihren Phasendiagrammen kann berechnet werden.
Wasserdampfdestillation
Wasserdampf kann in einer Mischung unter Destillation gepumpt werden. Beim sprudelnden Wasserdampf in der Flüssigkeit wird der Dampfdruck der Mischung erhöht, sodass er bei einer niedrigeren Temperatur kocht und die flüchtigsten Komponenten (wie Essenzen) extrahiert.
Vogel trinken
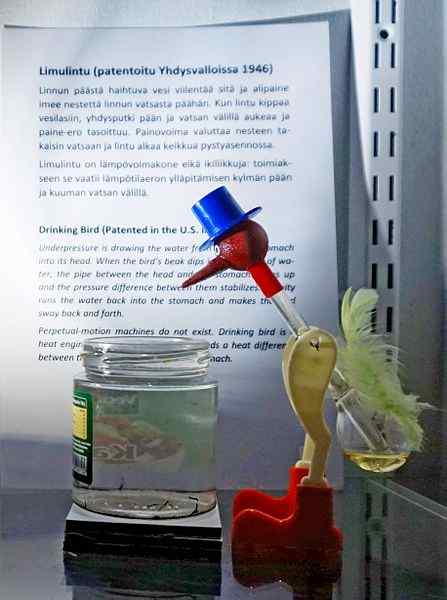 Trinkvogel, eines der genialsten Spielzeuge aller Zeiten. Quelle: Tiia Monto, CC BY-SA 4.0, über Wikimedia Commons
Trinkvogel, eines der genialsten Spielzeuge aller Zeiten. Quelle: Tiia Monto, CC BY-SA 4.0, über Wikimedia Commons Obwohl es nicht genau ein Gleichgewicht des Flüssigkeits-Dampfes ist, ist die Wahrheit, dass hinter der Operation des Trinkvogels mehrere thermodynamische Phänomene versteckt sind.
Wenn der Kopf des Vogels nass ist, beginnt er zu kühlen, wenn das Wasser verdunstet. Diese Temperaturabnahme führt zu einer Abnahme des Drucks im Kopf des Vogels. Das Methylenchlorid, das sich an der Basis des Vogels befindet, wird versuchen, die Drücke auszugleichen und durch ein Glasrohr zu fließen, das den Kopf mit dem Kopf verbindet.
Die Flüssigkeit wird sich zum Kopf des Vogels erheben, was sie schwerer macht und ihren Körper nach vorne neigt. Der Vogel dann "trinken Wasser" und der Dampfdruck balancieren ausbalancieren. Bildern Sie den Druck, der Vogel des Vogels kehrt in die vertikale Position zurück und der Zyklus wird wiederholt, während das Wasser des Kopfes wieder verdunstet.
Verweise
- Whitten, Davis, Peck & Stanley. (2008). Chemie. (8. Aufl.). Cengage Lernen.
- Walter J. Moore. (1962). Physikalische Chemie. (Vierte Edition). Longmans.
- Wikipedia. (2020). Dampf-Flüssigkeitsgleichgewicht. Abgerufen von: in.Wikipedia.Org
- Edvz et al. (5. November 2020). Dampf-Flüssigkeitsgleichgewicht. Chemistry Librettexts. Erholt von: Chem.Librettexts.Org
- Limer Eric. (30. Januar 2018). Eine absurd detaillierte Erklärung des Trinkvogelspielzeugs. Erholt von: populärmechanik.com
- Universität Alicante. (S.F.). Thema 4: Berechnung des Balance-Dampfes. Gleichgewichtsdiagramme. [PDF]. Geborgen von: Rua.Ua.Ist
- « Die 8 Arten von Intelligenz und wie sie identifiziert werden können
- Zweite industrielle Revolution »

