Paulingskala

- 4026
- 177
- Rieke Scheer
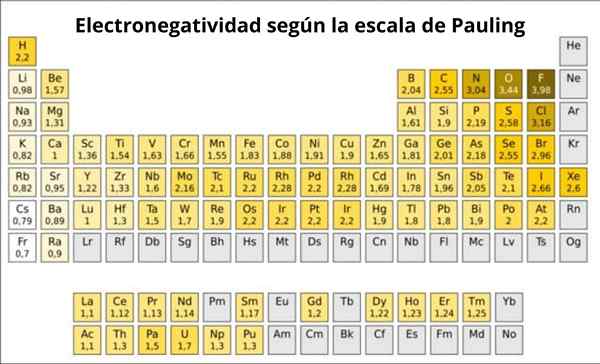 Abbildung 1. Paulingskala. Quelle: Wikimedia Commons.
Abbildung 1. Paulingskala. Quelle: Wikimedia Commons. Was ist die Pauling -Skala??
Der Paulingskala Es ist eine beliebige Skala, die in der Chemie verwendet wird, um die auszudrücken Elektronegativität der Elemente. Dies ist definiert als die Tendenz eines bestimmten Atoms, Elektronen in Kombination mit einem anderen Atom anzuziehen.
In diesem Sinne neigen die Elemente mit hoher Elektronegativitätselemente dazu, Elektronen leicht zu gewinnen. Dies sind Nichtmetalle, während es für sie für sie weniger elektronegative Elemente wie Metalle ist, ist es für sie einfacher, Elektronen zu ergeben.
Daher hat die Kenntnis der Elektronegativität eines Elements eine Vorstellung von der Art der Verbindung, die in der Lage ist, in Kombination mit einem anderen zu bilden. Wir werden dies später mit einem numerischen Beispiel sehen.
Mit diesen Informationen können Sie viele der Eigenschaften vorhersagen, die eine Verbindung haben wird, etwas, das sehr nützlich in der experimentellen Chemie und für die Wissenschaft der Material.
Es ist jedoch zweckmäßig zu klären, dass es trotz der wichtigen Art und Weise, wie wichtig es ist, keine einzigartige Möglichkeit gibt, die Elektronegativität zu bestimmen. Die Pauling -Skala ist nur eine der verschiedenen Formen, die vorgeschlagen wurden, sie zu finden, obwohl es eines der am häufigsten verwendeten ist.
Tatsächlich ist Paulings eine willkürliche Skala, in der jedes Element der Periodenzüchter ein numerischer Wert zugeordnet wird, der seine Elektronegativität widerspiegelt. Wir sehen es in Abbildung 1, wo Sie die Elektronegativität jedes Elements haben, wie der zweimals Nobelpreis Linus Pauling (1901-1994) um 1939 zugewiesen wurde.
Die Elektronegativität der Elemente
Pauling, neben Don M. Yost, fand die Elektronegativitätswerte empirisch durch experimentelle Daten, die durch Messung der Verbindungsenergie erhalten wurden.
Dem Fluor zugewiesenen Pauling.0. Wenn also Fluoridverbindungen bilden, weist es den höchsten Trend auf, Elektronen unter allen Elementen anzuziehen.
Es kann Ihnen dienen: Koordinationsnummer: Was ist, Berechnung, BeispieleZweitens ist Sauerstoff mit 3.5 und dritter ist Stickstoff mit 3.0. Beide befinden sich oben und rechts vom Tisch.
Andererseits ist am gegenüberliegenden Ende das am wenigsten elektronegative Element das Cäsium, dessen Symbol CS links von der Tabelle liegt, die Pauling die Nummer 0 zugewiesen hat.7.
Elektronegativität im Periodenzüchter
Im Allgemeinen und wie in Abbildung 1 beobachtet, steigt die Elektronegativität - und die Ionisationsenergie - in der Periodenzüchttabelle von links nach rechts an. Der allgemeine Trend zeigt auch eine Abnahme an, wenn Sie von oben nach unten bewegen.
Daher haben die elektronegativsten Elemente sie im oberen rechten Winkel der Tabelle: Fluor, Sauerstoff, Chlor, Stickstoff. Das am wenigsten elektronegativ -oder das elektropositive, wenn sie bevorzugt werden -wird links sein: Lithium, Natrium, Kalium und die anderen Elemente der Gruppe 1 -die Säule des extremen links, entspricht alkalischer und alkalischer Metalle-.
In jeder Säule nimmt die Elektronegativität ab, indem die Atomzahl des Elements erhöht wird, außer in Übergangsmetallen in der Mitte, die diesem Trend nicht folgen.
Ein wichtiger Punkt zum Hervorheben ist, dass die Elektronegativität relativ ist, keine unveränderliche Eigenschaft jedes Elements ist und nur in Bezug auf die anderer Elemente gemessen wird. Es hängt stark vom Oxidationszustand ab, sodass das gleiche Element je nach Art der Verbindung eine unterschiedliche Elektronegativität aufweisen kann.
Verknüpfungsenergiedifferenz
 Figur 2. Der amerikanische Chemiker Linus Pauling im Jahr 1955. Quelle: Wikimedia Commons.
Figur 2. Der amerikanische Chemiker Linus Pauling im Jahr 1955. Quelle: Wikimedia Commons. In der Chemie ist ein Link die Art und Weise, wie Atome, die gleichen oder unterschiedlich, zusammengefügt werden, um Moleküle zu bilden. Unter den Atomen sind Kräfte, die sie stabil zusammenhalten.
Es gibt verschiedene Arten von Link, aber zwei werden hier berücksichtigt:
- Kovalent, in denen Atome ähnlicher Elektronegativitäten einige Elektronen teilen.
- Ionisch, häufig zwischen Atomen mit unterschiedlichen Elektronegativitäten, bei denen die elektrostatische Anziehung vorherrscht.
Nehmen wir an, zwei Elemente A E B können Moleküle miteinander bilden, bezeichnet AA und BB. Und sie können sich auch zusammenschließen, um eine AB -Verbindung zu bilden, die durch eine Art von Linksart.
Dank der Teilnahme intermolekularer Kräfte liegt Energie in der Verbindung her. Zum Beispiel ist die Energie in der AA -Verbindung eAa, In der BB -Verbindung ist Ebb und schließlich in Verbindung AB ist eAb.
Wenn das AB -Molekül durch eine kovalente Bindung gebildet wird, ist die Verbindungsenergie theoretisch der Durchschnitt der Energien undAa und eBB:
UNDAb = ½ (eAa + UNDBB)
Pauling berechnet eAb Für mehrere Verbindungen misste es experimentell und bestimmte die Differenz zwischen den beiden Werten, die es δ nannte:
Δ = | (eAb) gemessen - (eAb) Theoretisch | = | (EAb) gemessen - ½ (eAa + UNDBB) |
Pausing hat so eingestuft: Wenn δ sehr nahe an 0 ist, bedeutet dies, dass die Elektronegativitäten beider Elemente ähnlich sind und die Verbindung, die sie vereint, kovalent ist. Aber wenn δ nicht klein ist, ist die Verbindung zwischen A und B nicht rein kovalent.
Je größer der Absolutwert von δ ist, desto größer ist die Differenz zwischen der Elektronegativität der Elemente A und B und damit der Verbindung, dass UNE vom ionischen Typ sein wird. Später wird der Leser ein Beispiel finden.
Gleichungen für die Elektronegativität
Ausgehend von der Tatsache, dass der Unterschied in der Energie das Signal ist, das die Natur des Zusammenhangs unterscheidet, hat Pauling viele Experimente durchgeführt, die ihn dazu veranlassten, einen empirischen Ausdruck für relative Elektronegativitäten von zwei Elementen zu E zu schaffen, die ein Molekül bilden.
Durch die Bezeichnung einer solchen Elektronegativität als χ (griechischer Buchstabe "Chi") definierte Pauling δ wie folgt:
F2· Δ = [χ (a) - χ (b)]2
χ (a) - χ (b) = f√δ = 0.102√δ
Kann Ihnen dienen: Tanteo Balance: Schritte, Beispiele und ÜbungenBeachten Sie, dass δ eine positive Menge ist. Fatia f = 0.102, die erscheint, die Quadratwurzel von δ zu multiplizieren, ist der Umwandlungsfaktor zwischen KJ (Kilojoule) und EV (Elektronenvolt), beide Energieeinheiten.
Wenn stattdessen Kilokalorien und Elektronenvolt verwendet werden, wird die Differenz der Elektronegativitäten mit einer ähnlichen Formel ausgedrückt, jedoch mit F = 0.208:
χ (a) - χ (b) = 0.208 Wände
Pauling begann Wasserstoff den Wert von 2 zuzuweisen.1, ein früherer Wert, der vom Chemiker Robert Mulliken erhalten wurde. Er wählte dieses Element als Ausgangspunkt aus, weil es kovalente Verbindungen zu vielen anderen bildet.
Durch die vorherige Gleichung zugewiesen er weiterhin Werte, die sich mit den Resten der Elemente beziehen. Es wurde erkannt.
Beispiel
Im Folgenden finden Sie eine Liste von Elementen: N, J und M und ihre jeweiligen Elektronegativitäten χ gemäß der Pauling -Skala:
-N: Χ = 4.0
-J: Χ = 1.5
-UND: Χ = 0.9
-M: Χ = 1.6
Unter den folgenden Verbindungen, die mit ihnen gebildet wurden:
Yj, yn, mn und jm
Weisen auf den mit dem größten ionischen Charakter und auf die, deren Natur kovalent ist. Grund Ihre Antwort.
Lösung
Nach den durch Pauling festgelegten Kriterien wird die Verbindung mit dem höchsten ionischen Charakter die mit dem größten Unterschied zwischen Elektronegativitäten und damit ein höherer Wert von δ sein. Die Verbindung mit der niedrigsten Energiedifferenz ist diejenige, die eine kovalente Bindung hat.
Dann werden wir berechnen, wie viel δ für jede Verbindung wert ist, wie folgt:
Verbindung YJ
Δ = [χ (y) - χ (j)]2 = (0.9 - 1.5)2 = 0.36
Yn Compound
Δ = [χ (y) - χ (N)]]]2 = (0.9 - 4.0)2 = 9.61
Verbindung Mn
Δ = [χ (M) - χ (N)]2 = (1.6 - 4.0)2 = 5.76
JM -Verbindung
Δ = [χ (j) - χ (m)]2 = (1.5 - 1.6)2 = 0.01
Aus den obigen Ergebnissen folgt, dass die Verbindung des ionischen Charakters das YN ist, dessen Δ = 9.61, während die Verbindung des kovalenten Zeichens der JM ist, mit δ = 0.01.

