Strukturdose, Eigenschaften, erhalten, verwendet, verwendet

- 1635
- 465
- Jasmine Kupprion
Er Zinn Es ist ein Metall, das zum Block gehört P des periodischen Tisches, dessen chemisches Symbol SN ist und sich in Gruppe 14 befindet, dem Kohlenstoff. Obwohl es seit der Antike ein weit verbreitetes Metall ist, ist es die Wahrheit, dass es sich um ein knappes Metall in der Erdkruste handelt (2).3 ppm).
Es ist ein silberndes, weiches, duktiles und formbares Metall. Es hat eine Atomzahl von 50 und seine vorherrschenden Zustände oder Oxidationszahlen beträgt +2 (SN2+) und +4 (sn4+), Die Verbindungen von Zinn (II), wie der SNCL2, Gute Reduziermittel.
 Zinn Alotropes. Quelle: Zinn_9.JPG: Von: Benutzer: Tomihahndorf.Ableitungsarbeit: MaterialScientist/CC BY-S (https: // CreateRecommons.Org/lizenzen/by-sa/2.0)
Zinn Alotropes. Quelle: Zinn_9.JPG: Von: Benutzer: Tomihahndorf.Ableitungsarbeit: MaterialScientist/CC BY-S (https: // CreateRecommons.Org/lizenzen/by-sa/2.0) Die Dose hat als Symbol SN, eine Abkürzung des lateinischen Wortes "Stannum". Zinn ist ein Metall, das gegen Wasserangriff und Luft bei Raumtemperatur beständig ist. Aber in heißen Luft bildet Blechdioxid, SNAM2.
Die Eigenschaft, Korrosionsbeständigkeit zu resistent und einen niedrigen Schmelzpunkt zu haben, hat zahlreiche Anwendungen dient. wie die Beschichtung von Metalloberflächen und Schweißen.
Die Dose hat zwei wichtige allotrige Formen: die weiße und feste β -Form; und die α-, grauen und normalerweise staubigen Kontexte (spröde). Daher ist die β -Form die am häufigsten in Zinnanwendungen verwendete Anwendungen.
Eine weitere wichtige Eigenschaft von Zinn ist seine Fähigkeit, Teil von Legierungen mit mehreren Metallen zu sein, wobei das älteste Bronze, eine Legierung von Kupfer und Zinn ist.
[TOC]
Entdeckung
 Zinngranulat. Quelle: Nepronus, CC0, über Wikimedia Commons
Zinngranulat. Quelle: Nepronus, CC0, über Wikimedia Commons Zinn ist ein Metall, das seit der Antike bekannt ist. Daher ist nicht bekannt, wer sein Entdecker war; Und viel weniger das Jahr und den Ort seiner Entdeckung.
Bronze ist eine Kupferlegierung mit Zinn und Arsen. Es ist möglich, dass die Ausarbeitung dieser Legierung eine Folge einer zufälligen und unbeabsichtigten Tatsache ist, da die ersten Bronzeobjekte - in der Bronzezeit - durch Kupfer und nur Arsenspuren gebildet wurden.
Diese Objekte erschienen im Nahen Osten, wo Arsen mit Kupfer verbunden ist. Von Anfang an wurde die Toxizität des Arsens nachgewiesen, wobei der Ersatz erreicht wurde2).
Die alten Griechen erhielten Zinn durch maritime Handel und bezeichneten die Quelle ihrer Zinn als "die Kassiterides", was "Zinninseln" bedeutet,. Es ist möglich, dass sich diese Inseln in Cornuelles, Britisch oder Spanien befanden, wo es große Zinnablagerungen gibt.
Es kann Ihnen dienen: Bismuts subsalicylat: Struktur, Eigenschaften, Verwendungen, EffekteChemische Zinnstruktur
Wenn es zwei Alotrope gibt: das weiße Zinn oder die β-SN und die graue Dose oder α-SN, haben wir zwei kristalline Strukturen. Das β-SN ist tetragonal auf dem Körper (BCT) zentriert, was die Formbarkeit der weißen Dose charakterisiert.
Inzwischen ist die Struktur des α-SN Diamant; Das heißt, die SN -Atome sind mit Tetrahedernetzen miteinander verbunden, ohne dass überhaupt eine Metallbindung existiert.
Die Dose zeigt auch zwei weitere Alotrope unter verschiedenen Druckbedingungen (in der Größenordnung der GPA) und der Temperatur (über 161 ° C): σ-SN und γ-SN.
Elektronische Konfiguration
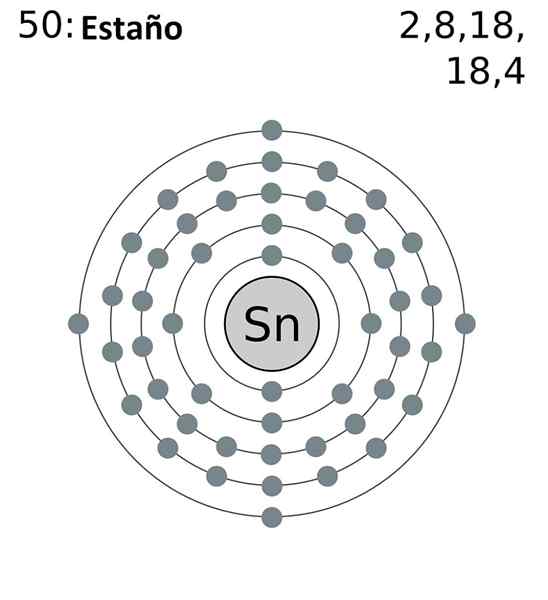
Die elektronische Konfiguration der Zinnabkürzung lautet wie folgt:
[Kr] 4d10 5s2 5 p2
Hinzufügen aller Elektronen haben insgesamt 14, die gleiche Zahl, die Ihrer Gruppe entspricht. Es sind jedoch nur die Elektronen der 5S- und 5p -Orbitale diejenigen, die an den chemischen Reaktionen der Dose teilnehmen, da die der 4D nicht energetisch verfügbar sind.
Zinneigenschaften
Aussehen und physikalische Eigenschaften
Zinn ist ein weiches, duktiles und formbares Metall, das kalt und dreht sein kann. Sein niedriger Schmelzpunkt ermöglicht es, sich an sauberen Oberflächen von Metallen oder Legierungen wie Stahl, Kupfer und seinen Legierungen zu halten, wodurch sie vor Oxidation geschützt werden.
Wenn ein Zinnstück gefaltet ist, schneidet es ein charakteristisches Klang.
Zinn hat zwei allopische Formen: β und α. Die β -Form entspricht einem weißen Feststoff und ist für Zinnanwendungen verantwortlich. Während die α -Form ein graues Pulver ist.
 Zinnort im Periodenzüchtertisch. Quelle: Bild von Daniel Mayer oder Greatpatton und unter Beweis der GNU -FDL veröffentlicht
Zinnort im Periodenzüchtertisch. Quelle: Bild von Daniel Mayer oder Greatpatton und unter Beweis der GNU -FDL veröffentlicht Die β -Form wird bei Temperaturen über 13 dargestellt.2 ºC. Wenn die Temperatur sinkt 13.2 ºC, Zinnänderungen von β -Form zur α -Form. Dieses Phänomen ist unerwünscht und wird vermieden, indem andere Metalle wie Antimon oder Wismut hinzugefügt werden, die diese Veränderung blockieren und ihre Nutzungsdauer verlängern.
Zinn ist die erste Superkonferenz, die bei Temperaturen unter 3 bekannt ist.72 k.
Ordnungszahl
fünfzig
Molmasse
118.71 g/mol
Schmelzpunkt
231.93 ºC
Siedepunkt
2602 ºC
Dichte
Alotropo β: 7.265 g/cm3
Alotropo α: 5.769 g/cm3
Oxidationszustände
Zinn hat mehrere Oxidationszustände: -4, -3, -2, -1, 0, +1, +2, +3, +4. Die meisten ihrer Verbindungen haben jedoch die Dose mit Oxidationszuständen +2 (SN)2+) und +4 (sn4+).
Kann Ihnen dienen: organische VerbindungenIonisationsenergien
Erstens: 708.6 kJ/mol
Zweitens: 1411.8 kJ/mol
Drittens: 2943.0 kJ/mol
Elektronegativität
1.96 auf der Paulingskala
Reaktivität
Zinn ist ein Metall, das bei Raumtemperatur gegen Luft- und Wasserwirkung resistent ist, aber wenn sie in der Luft erhitzt wird, bildet sie Zinnoxid (iv), SNAM2, das ist schwach sauer. Es wird von Säuren und Alkalien angegriffen und kann in Gegenwart von Sauerstoff in einigen Fällen als Katalysator wirken.
Erhalten
 Casiteritenmineral ist die wichtigste Mineralogische Zinnquelle. Quelle: Rob Lavinsky, Irocks.com-c-by-sa-3.0/cc By-SA (https: // CreePecommons.Org/lizenzen/by-sa/3.0)
Casiteritenmineral ist die wichtigste Mineralogische Zinnquelle. Quelle: Rob Lavinsky, Irocks.com-c-by-sa-3.0/cc By-SA (https: // CreePecommons.Org/lizenzen/by-sa/3.0) Das Zinn aus Sicht seines Vorkommens ist ein seltenes Metall, da es eine Fülle in der Erdrinde von nur 2 ppm hat. Casiteritenmineral, ein Zinnoxidmineral, ist die einzige kommerzielle Zinnquelle.
Der Casiterit ist ein schwärzliches Mineral, das sich auf schlammigen Geländen am Ufer der Flüsse befindet. Die Dose wird aus dem Casiterit extrahiert, indem bis zu 1370 ° C mit Kohle oder Koks erwärmt wird, um seine Reduktion zu erzeugen.
Die produzierte Dose ist unrein und wird daher mit Natriumhydroxid oder Salzsäure behandelt, um die Zinn zu löschen. Dann ist dies der Elektrolyse ausgesetzt, die Zinnanode und die Eisenkathode ist. Die Dose wird auf der Kathode abgelagert, mit einer Reinheit von mehr als 90%.
Verwendet/Anwendungen
Korrosionsschutz
Zinn ist korrosionsbeständiges Metall. Die sogenannte Dose oder Dose ist ein Stahlbehälter, der mit einer Blechschicht bedeckt ist, um Oxidation zu vermeiden.
Die Dosen wurden verwendet, um Lebensmittel und andere Substanzen aufzubewahren, zum Beispiel: Gemälde, Lack, Lösungsmittel usw. Aber sie werden derzeit durch Aluminium- oder Plastikbehälter ersetzt. Zinnbeschichtete Rohre und Ventile erhalten Wasser und trinken Reinheit.
Legierungen
 Die erste Verwendung für Zinnlegierungen bestand darin, Behälter oder Utensilien wie Dosen und Krüge dieser Speisekammer herzustellen. Quelle: Butterfly Voyages - Serge Ouachée/CC by -sa (https: // creativeCommons.Org/lizenzen/by-sa/3.0)
Die erste Verwendung für Zinnlegierungen bestand darin, Behälter oder Utensilien wie Dosen und Krüge dieser Speisekammer herzustellen. Quelle: Butterfly Voyages - Serge Ouachée/CC by -sa (https: // creativeCommons.Org/lizenzen/by-sa/3.0) Der Mann begann mehr als 5000 Jahre lang Bronze zu benutzen. Bronze ist eine Legierung von Kupfer und Dose, die bei der Ausarbeitung von Werkzeugen, Waffen und Haushaltsutensilien verwendet wird.
Auf die gleiche Weise wurde die Peeling, eine Legierung, die anfänglich aus Zinn und Blei war, zur Herstellung von Töpfen, Tellern usw. verwendet. Aufgrund der Blei -Toxizität wird Peel derzeit mit Zinn-, Antimon- und Kobaltlegierung hergestellt.
Es kann Ihnen dienen: hypoyodöse Säure (HIO)Die Zinnlegierung und das Blei haben einen niedrigen Schmelzpunkt, der seine Verwendung beim Schweißen ermöglicht hat, eine Technik, die dazu dient, Teile zusammenzustellen, die in elektrischen und elektronischen Schaltungen vorhanden sind. Es gibt Autos, in denen die Dose mit Eisen legiert ist, während sie in Luft- und Raumfahrtfahrzeugen Aluminium, Zinn- und Titanlegierungen verwendet werden.
Zirkoniumlegierungen, auch Zircaloys genannt, werden in Kernreaktoren verwendet und haben eine kleine Menge Zinn.
 Zinnproben. Quelle: Ondřej Manggl, Public Domain, über Wikimedia Commons
Zinnproben. Quelle: Ondřej Manggl, Public Domain, über Wikimedia Commons Die Legierung von Silber und Zinn wurde in Zahnamalgamen verwendet.
Eine kristalline Legierung mit dem Niobio -Element ist eine Superkonferenz, die bei einer Temperatur von 18 K arbeitet und seine Eigenschaft in einem starken Magnetfeld aufrechterhält.
Glas
Die Dose wird im Pilkington -Verfahren zur Herstellung von Fensterglas verwendet. Das geschmolzene Glas wird auf eine geschmolzene Zinnoberfläche gelegt, wobei das Glas eine flache und glatte Oberfläche erfasst wird. Diese Technik wird immer noch erfolgreich eingesetzt.
Blechsalze werden auf das Glas besprüht, um eine leitende Kraftfutter zu erhalten, in der sie Leuchtplatten und Windschutzscheibe ohne Frost herstellen können.
Zinnverbindungen
Sündiges Chlorid (SNCL2) Es wird in Zinnvergaser und als Reduktionsmittel bei der Herstellung von Polymeren und Farbstoffen verwendet. Zinnfluorid (SNF2) Es ist ein Wirkstoff in Zahnpasten.
Inzwischen ist sein Oxid ein nützlicher Katalysator in bestimmten industriellen Prozessen. Außerdem wird es als Pulver zum polnischen Stahl verwendet.
Organische Zinnverbindungen werden als Biozide und Fungizide verwendet und sind für den Menschen giftig. Organische Zinnstabilisatoren werden verwendet, um Änderungen des Polyvinylchlorids aufgrund von Licht- und Wärme -Exposition zu verhindern.
Das Chlorid Isñico (SNCL4) wird als Parfümstabilisator und als Ausgangsmaterial für andere Blechsalz verwendet.
Verweise
- Shiver & Atkins. (2008). Anorganische Chemie. (vierte Edition). Mc Graw Hill.
- Wikipedia. (2020). Zinn. Abgerufen von: in.Wikipedia.Org
- Nationales Zentrum für Biotechnologieinformationen (2020). Zinn. Pubchem Comunund -Zusammenfassung für CID 23974. Erholt von: Pubchem.NCBI.NLM.NIH.Regierung
- DR. Doug Stewart. (2020). Fakten mit Blechelement. Erholt von: Chemicoolool.com
- Die Herausgeber von Enyclopaedia Britannica. (2020). Zinn. Erholt von: Britannica.com
- Bell, Terence. (26. August 2020). Die Eigenschaften, Produktion und Anwendungen von Zinn. Erholt von: thoughtco.com
- Lentech b.V. (2020). Zinn. Erholt von: lentech.com
- Stephanie Puppen. (28. Juli 2015). Fakten über Zinn. Erholt von: Livescience.com
- AIP -Konferenzverfahren. (9. Februar 2018). Zinnrückgewinnung von der Zinnschlacke unter Verwendung von Elektrolyseverfahren. doi.org/10.1063/1.5024070

