Lewis strukturieren, woraus es besteht, wie es getan wird, Beispiele

- 965
- 115
- Medine Kedzierski
Der Lewis -Struktur Es ist alles diese Darstellung kovalenter Bindungen innerhalb eines Moleküls oder eines Ions. Darin sind diese Bindungen und Elektronen mit langen Punkten oder Skripten dargestellt, obwohl die Punkte die nicht gemeinsam genutzten Elektronen und die Skripte der kovalenten Bindungen entsprechen.
Aber was ist eine kovalente Verbindung?? Es ist das Teilen einiger Elektronen (oder Punkte) zwischen zwei Atomen der Periodenzüchtertabelle. Mit diesen Diagrammen können Sie viele Skelette für eine bestimmte Verbindung skizzieren. Welcher von ihnen ist das Richtige, hängt von den formalen Belastungen und der chemischen Natur derselben Atome ab.
 2-Bromopropan-Verbindung. Von Ben Million [Public Domain] aus Wikimedia Commons.
2-Bromopropan-Verbindung. Von Ben Million [Public Domain] aus Wikimedia Commons. Im überlegenen Bild gibt es ein Beispiel dafür, was eine Lewis -Struktur ist. In diesem Fall ist die dargestellte Verbindung 2-Bromopropano. Die schwarzen Punkte, die den Elektronen entsprechen, sind zu sehen, sowohl diejenigen, die an den Links teilnehmen als nicht geteilt (das einzige Drehmoment direkt über dem BR).
Wenn die Punkte der Punkte ":" durch ein langes Drehbuch ersetzt würden "-", dann würde das Kohlenstoffskelett des 2-Bromopropano als: C-C-C dargestellt werden: C-C-C. Warum anstelle des "molekularen Rahmens" gezeichnet, könnte es C-H-H-C sein? Die Antwort liegt in den elektronischen Eigenschaften jedes Atoms.
Da Wasserstoff also nur ein Elektron und ein einzelnes Orbital zur Verfügung hat, ist nur eine kovalente Bindung. Daher können Sie niemals zwei Bindungen bilden (nicht mit Wasserstoffbrücken verwechselt). Andererseits ermöglicht die elektronische Konfiguration des Kohlenstoffatoms die Bildung von vier kovalenten Bindungen.
Aus diesem Grund müssen Lewis 'Strukturen, in denen C und H konsistent sein müssen, und respektieren, was durch ihre elektronischen Konfigurationen bestimmt wird. Auf diese Weise kann die Skizze ausgeschlossen werden, wenn Carbon mehr als vier Bindungen oder Wasserstoff mehr als ein.
Hier erscheinen einige der Hauptgründe oder Rücken dieser Strukturen, die von Gilbert Newton Lewis auf der Suche nach molekularen Darstellungen, die experimentellen Daten treu sind.
Alle vorhandenen Verbindungen können durch Lewis -Strukturen dargestellt werden, was einen ersten Ansatz dafür gibt, wie das Molekül oder die Ionen sein könnten.
[TOC]
Was ist Lewis 'Struktur?
Es handelt.
Diese Struktur prognostiziert jedoch einige wichtige Details wie molekulare Geometrie in Bezug auf ein Atom und seine Umgebung (wenn es quadratisch, flach, bipiramidal usw. ist.).
Es sagt auch nichts darüber aus.
Mit diesen Informationen können Sie über die Reaktivität einer Verbindung, ihre Stabilität, wie und welcher Mechanismus das Molekül bei der Reaktion folgen wird.
Aus diesem Grund hören Lewis 'Strukturen nie auf, berücksichtigt zu werden und sind sehr nützlich, da sie neues chemisches Lernen kondensieren können.
Wie wird es gemacht?
Um eine Struktur, eine Formel oder ein Lewis -Diagramm zu zeichnen oder zu skizzieren, ist die chemische Formel der Verbindung essentiell. Ohne sie kann man nicht einmal wissen, welche Atome es ausmachen. Einmal damit wird die Periodenzüchter verwendet, um zu lokalisieren, welche Gruppen gehören.
Kann Ihnen dienen: Viskosität: Beispiele, Ursachen, Einheiten, TypenZum Beispiel, wenn Sie Verbindung c haben14ENTWEDER2N3 Dann müssten wir nach den Gruppen suchen, in denen Kohlenstoff, Sauerstoff und Stickstoff sind. Dies geschafft, unabhängig von der Verbindung bleibt die Anzahl der Valenzelektronen gleich, so früher oder später, sie merken.
Somit gehört Kohlenstoff zur Mehrwertsteuergruppe, Sauerstoff zur Via -Gruppe und Stickstoff zur VA. Die Gruppenzahl entspricht der Menge an Elektronen (Punkten) von Valencia. Alle von ihnen haben gemeinsam die Tendenz, den Oktett der Valencia -Schicht zu vervollständigen.
Was ist die Oktettregel?
Dies heißt. Dies gilt für alle nicht -metallischen Elemente oder für diejenigen, die in Blöcken S oder P der Periodenzüchter enthalten sind.
Allerdings folgen nicht alle Elemente der Oktettregel. Besondere Fälle sind Übergangsmetalle, deren Strukturen eher auf formalen Lasten und ihrer Gruppennummer basieren.
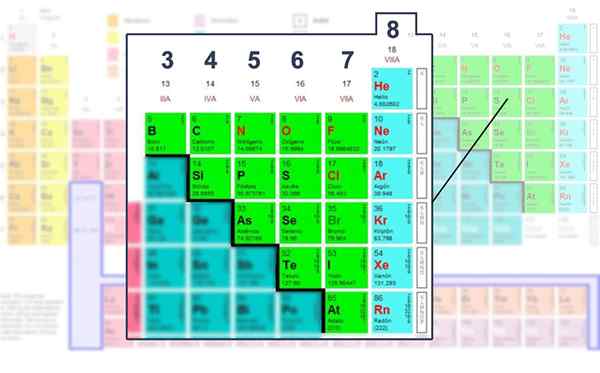 Anzahl der Elektronen der Valencia -Schicht der nicht -metallischen Elemente, in denen sie mit der Lewis -Struktur betrieben werden können.
Anzahl der Elektronen der Valencia -Schicht der nicht -metallischen Elemente, in denen sie mit der Lewis -Struktur betrieben werden können. Anwendung der mathematischen Formel
Wenn Sie wissen, welche Gruppe die Elemente gehören, und damit die Anzahl der Valenzelektronen, die zur Bildung von Links verfügbar sind, wird die folgende Formel erstellt, was zum Zeichnen von Lewis -Strukturen nützlich ist:
C = n - d
Wo c bedeutet gemeinsame Elektronen, Das heißt, diejenigen, die an den kovalenten Bindungen teilnehmen. Da jede Verbindung aus zwei Elektronen besteht, ist C/2 gleich der Anzahl der Links (oder Skripte), die gezeichnet werden müssen.
N sind die notwendige Elektronen, Diejenigen, die das Atom in seiner Valencia -Schicht haben müssen, um isolektronisch gegenüber dem im gleichen Zeitraum folgenen edlen Gas zu sein. Für alle anderen Elemente als H (da es zwei Elektronen benötigt, um sich mit er zu vergleichen) brauchen sie acht Elektronen.
D sind die Verfügbare Elektronen, die durch die Gruppe oder die Elektronenzahl von Valencia bestimmt werden. Da das CL zu Gruppe VIIA gehört, muss es also von sieben Schwarz oder Elektronen umgeben sein und beachten, dass ein Paar benötigt wird, um eine Verbindung zu bilden.
Mit den Atomen, ihren Punkten und der Anzahl der Links C/2 kann eine Lewis -Struktur improvisiert werden. Darüber hinaus ist es jedoch notwendig, die Vorstellung von anderen "Regeln" zu haben.
Wo kann die weniger elektronegativen Atome platziert werden
Die weniger elektronegativen Atome in der überwiegenden Mehrheit der Strukturen belegen die Zentren. Wenn Sie aus diesem Grund eine Verbindung mit Atomen von P, O und F haben, muss sich das P daher in der Mitte der hypothetischen Struktur befinden.
Es ist auch wichtig hervorzuheben, dass Hydrogene normalerweise mit sehr elektronegativen Atomen verbunden sind. Wenn Sie in einem Zn-, H- und O-Verband haben, wird das H neben das O und nicht mit dem Zn (Zn-O-H und kein H-Zn-O) gehen. Es gibt Ausnahmen von dieser Regel, tritt jedoch normalerweise bei nicht -metallischen Atomen auf.
Symmetrie und formale Lasten
Die Natur hat eine hohe Präferenz, molekulare Strukturen so symmetrisch wie möglich zu verursachen. Dies hilft, ungeordnete Strukturen zu vermeiden, wobei die Atome so angeordnet sind, dass sie kein scheinbarem Muster befolgen.
Es kann Ihnen dienen: Säure-Bass-Theorien: Arrhenius, Bronsted-Lowry, LewisZum Beispiel für Verbindung c2ZU3, Wenn a ein fiktives Atom ist, wäre die wahrscheinlichste Struktur A-C-A-C-A. Beachten Sie die Symmetrie ihrer Seiten, beide Reflexionen des anderen.
Formale Lasten spielen auch eine wichtige Rolle beim Zeichnen von Lewis 'Strukturen, insbesondere für Ionen. Somit können Links hinzugefügt oder entfernt werden, damit die formale Last eines Atoms der angezeigten Gesamtlast entspricht. Dieses Kriterium ist sehr hilfreich für Übergangsmetallverbindungen.
Einschränkungen in der Oktettregel
 Aluminium -Trifluorid -Darstellung, eine Verbindung, die instabil ist. Beide Elemente bestehen aus sechs Elektronen, die drei kovalente Bindungen erzeugen, wenn sie acht sein sollten, um Stabilität zu erreichen. Quelle: Gabriel Bolívar
Aluminium -Trifluorid -Darstellung, eine Verbindung, die instabil ist. Beide Elemente bestehen aus sechs Elektronen, die drei kovalente Bindungen erzeugen, wenn sie acht sein sollten, um Stabilität zu erreichen. Quelle: Gabriel Bolívar Nicht alle Regeln werden erfüllt, was nicht unbedingt bedeutet, dass die Struktur falsch ist. Typische Beispiele hierfür werden in vielen Verbindungen beobachtet, in denen Elemente der Gruppe IIIa (B, Al, Ga, IN, TL) beteiligt sind. Hier gilt ausdrücklich als Aluminium trifluoruro (ALF3).
Anschließend die oben beschriebene Formel anwenden, haben Sie:
D = 1 × 3 (ein Aluminiumatom) + 7 × 3 (drei Fluoratome) = 24 Elektronen
Hier zu 3 und 7 sind die jeweiligen Gruppen oder Anzahl der Valenzelektronen für Aluminium und Fluorid verfügbar. In Anbetracht der erforderlichen Elektronen n:
N = 8 × 1 (ein Aluminiumatom) + 8 × 3 (drei Fluoratome) = 32 Elektronen
Und deshalb sind die gemeinsamen Elektronen:
C = n - d
C = 32 - 24 = 8 Elektronen
C/2 = 4 Links
Da Aluminium das am wenigsten elektronegative Atom ist, muss es in die Mitte platziert werden, und das Fluor bildet nur eine Verbindung. In Anbetracht dessen haben Sie die Lewis del ALF -Struktur3 (oberes Bild). Gemeinsame Elektronen werden mit grünen Punkten hervorgehoben, um sie von der Unbekümmerten zu unterscheiden.
Obwohl die Berechnungen vorhersagen, dass 4 Links gebildet werden müssen, fehlen Aluminium ausreichend Elektronen und es gibt auch kein viertes Fluoratom. Infolgedessen entspricht Aluminium nicht der Oktettregel, und diese Tatsache spiegelt sich nicht in den Berechnungen wider.
Beispiele für Lewis -Strukturen
Jod
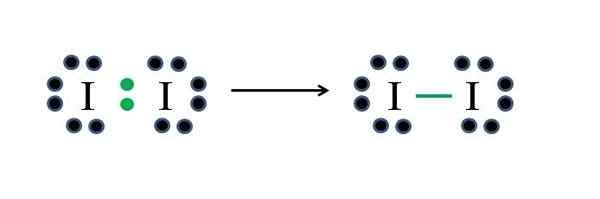 IODO -Metalle haben jeweils sieben Elektronen. Wenn sie also jeweils eine dieser Elektronen teilen, erzeugen sie eine kovalente Bindung, die ihnen Stabilität verleiht. Quelle: Gabriel Bolívar
IODO -Metalle haben jeweils sieben Elektronen. Wenn sie also jeweils eine dieser Elektronen teilen, erzeugen sie eine kovalente Bindung, die ihnen Stabilität verleiht. Quelle: Gabriel Bolívar Jod ist ein Halogen und gehört daher zu Gruppe VIIA. Es hat dann sieben Elektronen Valencia, und dieses einfache diatomische Molekül kann improvisieren oder die Formel anwenden:
D = 2 × 7 (zwei Iodatome) = 14 Elektronen
N = 2 × 8 = 16 Elektronen
C = 16 - 14 = 2 Elektronen
C/2 = 1 Link
Da 14 Elektronen 2 an der kovalenten Bindung (grüne Punkte und Skript) teilnehmen, bleiben 12 nicht geteilt; Und weil es sich um zwei Jodatome handelt, muss 6 für einen von ihnen verteilt werden (ihre Valenzelektronen). In diesem Molekül ist nur diese Struktur möglich, deren Geometrie linear ist.
Ammoniak
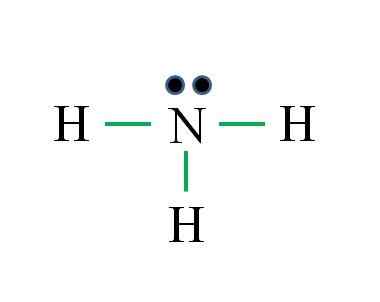 Stickstoff hat 5 Elektronen, während Wasserstoff nur 1. Ausreichend, um Stabilität zu erreichen, wenn drei kovalente Bindungen festgelegt werden, die aus einem Elektron von N und einem anderen von H -Quelle bestehen: Gabriel Bolívar
Stickstoff hat 5 Elektronen, während Wasserstoff nur 1. Ausreichend, um Stabilität zu erreichen, wenn drei kovalente Bindungen festgelegt werden, die aus einem Elektron von N und einem anderen von H -Quelle bestehen: Gabriel Bolívar Was ist Lewis 'Struktur für Ammoniakmolekül? Da Stickstoff aus der VA -Gruppe stammt, hat er fünf Elektronen Valencia und dann:
Es kann Ihnen dienen: Labor -Thermometer: Eigenschaften, wofür es, für die Verwendung, BeispieleD = 1 × 5 (ein Stickstoffatom) + 1 × 3 (drei Wasserstoffatome) = 8 Elektronen
N = 8 × 1 + 2 × 3 = 14 Elektronen
C = 14 - 8 = 6 Elektronen
C/2 = 3 Links
Dieses Mal stimmt die Formel mit der Anzahl der Links (drei grüne Links). Ab den 8 verfügbaren Elektronen 6 beteiligen sich an den Bindungen ein nicht stammes Drehmoment über dem Stickstoffatom.
Diese Struktur sagt alles, was von der Ammoniakbasis bekannt sein sollte. Wenn Sie das Wissen über TEV und TRPEV anwenden, wird folgt, dass die Geometrie durch das freie Stickstoffdrehmoment tetraedrisch verzerrt wird und dass die Hybridisierung daher SP ist3.
C2H6ENTWEDER
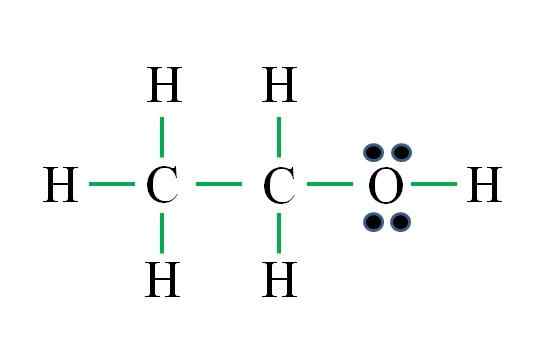 Quelle: Gabriel Bolívar
Quelle: Gabriel Bolívar Die Formel entspricht einer organischen Verbindung. Vor der Anwendung der Formel sollte erinnert werden. Fortschritte wie die vorherigen Beispiele sind:
D = 6 × 1 (sechs Wasserstoffatome) + 6 × 1 (ein Sauerstoffatom) + 4 × 2 (zwei Kohlenstoffatome) = 20 Elektronen
N = 6 × 2 (sechs Wasserstoffatome) + 8 × 1 (ein Sauerstoffatom) + 8 × 2 (zwei Kohlenstoffatome) = 36 Elektronen
C = 36 - 20 = 16 Elektronen
C/2 = 8 Links
Die Anzahl der grünen Skripte entspricht den 8 berechneten Links. Die vorgeschlagene Lewis -Struktur ist die von Ethanol ch3CH2Oh. Es wäre jedoch auch korrekt gewesen, die Struktur des Dimethylethers vorzuschlagen3Och3, das ist noch symmetrischer.
Welcher der beiden ist "mehr" richtig?? Beide sind gleichermaßen, da die Strukturen als strukturelle Isomere derselben molekularen Formel C entstanden sind2H6ENTWEDER.
Permanganation
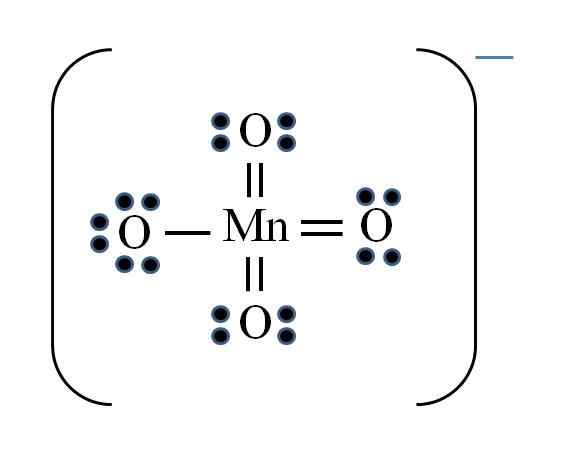 Quelle: Gabriel Bolívar
Quelle: Gabriel Bolívar Die Situation ist kompliziert, wenn Sie Lewis -Strukturen für Übergangsmetallverbindungen durchführen möchten. Das Mangan gehört zur VIIB -Gruppe, auch das Elektron der negativen Belastung muss unter den verfügbaren Elektronen hinzugefügt werden. Anwenden der Formel, die Sie haben:
D = 7 × 1 (ein Manganatom) + 6 × 4 (vier Sauerstoffatome) + 1 Elektron pro Last = 32 Elektronen
N = 8 × 1 + 8 × 4 = 40 Elektronen
C = 40 - 32 = 8 gemeinsame Elektronen
C/2 = 4 Links
Übergangsmetalle können jedoch mehr als acht Elektronen in Valencia haben. Auch für das Mno -Ion4- Zeigt die negative Belastung, es ist notwendig, die formalen Ladung von Sauerstoffatomen zu reduzieren. Als? Durch die doppelten Links.
Wenn alle Links des MNO4- Sie waren einfach, die formalen Lasten des Sauerstoffs würden -1 entsprechen. Da es vier gibt, wäre die resultierende Last für Anion -4, was offensichtlich nicht wahr ist. Wenn die Doppelbindungen gebildet werden, wird garantiert, dass ein einzelner Sauerstoff eine negative formale Belastung hat, die sich im Ion widerspiegelt.
Im Permanganation ist ersichtlich, dass es Resonanz gibt. Dies impliziert, dass die einzige einfache Mn-O-Verbindung zwischen den vier Atomen von O demokalisiert wird.
Dicromato Ion
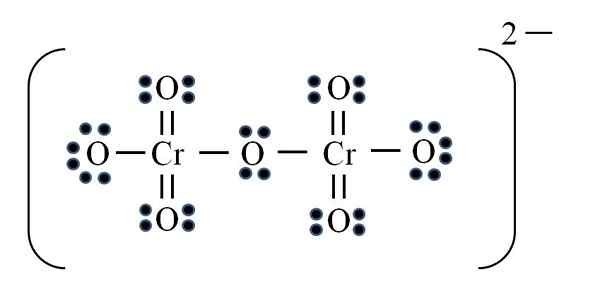 Quelle: Gabriel Bolívar
Quelle: Gabriel Bolívar Schließlich tritt ein ähnlicher Fall mit dem Dicromato -Ion auf (Cr)2ENTWEDER7). Das Chrom gehört zur VIB -Gruppe, so dass es sechs Elektronen von Valencia hat. Nutzung der Formel erneut anwenden:
D = 6 × 2 (zwei Chromatome) + 6 × 7 (sieben Sauerstoffatome) + 2 Elektronen durch die zweiwertige Last = 56 Elektronen
N = 8 × 2 + 8 × 7 = 72 Elektronen
C = 72 - 56 = 16 gemeinsame Elektronen
C/2 = 8 Links
Aber es gibt keine 8 Links, sondern 12. Aus den gleichen Gründen müssen im Permanganation zwei Sauerstoff mit negativen formalen Lasten zurückgelassen werden.
So werden bei Bedarf viele doppelte Links hinzugefügt. Auf diese Weise erreichen Sie die Lewis -Struktur des Bildes für die CR2ENTWEDER72-.
Verweise
- Whitten, Davis, Peck & Stanley. Chemie. (8. Aufl.). Cengage Learning, S. 251.
- Lewis -Strukturen. Genommen von: Chemed.Chem.Purdue.Edu
- Steven a. Hardinger, Abteilung für Chemie und Biochemie, UCLA. (2017). Lewis -Struktur. Genommen von: Chem.UCLA.Edu
- Wayne Breslyn. (2012). Zeichnen von Lewis -Strukturen. Entnommen aus: TerpConnect.Umd.Edu
- Webmaster. (2012). Lewis ("Electron Dot") Strukturen. Abteilung für Chemie, Universität von Maine, Orono. Entnommen aus: Chemie.Umeche.Maine.Edu
- Lancaster, Sean. (25. April 2017). Wie man bestimmt, wie viele Punkte auf der Lewis Dot -Struktur eines Elements enthalten sind. Wissenschaftlich. Erholt von: Scienting.com

