Primärstruktur von Merkmalen
- 1447
- 291
- René Riediger
Der Primärstruktur von Proteinen Es ist die Reihenfolge, in der die Aminosäuren der Polypeptide angeordnet sind. Ein Protein ist ein Biopolymer, das von α-Aminosäure-Monomeren gebildet wird, die durch Peptidbindungen vereint sind. Jedes Protein hat eine bestimmte Sequenz dieser Aminosäuren.
Proteine führen eine große Vielfalt biologischer Funktionen aus, einschließlich Form und Aufrechterhaltung der Integrität von Zellen durch Zytoskelett, verteidigen den Körper seltsamer Mittel durch Antikörper und katalysieren die chemischen Reaktionen des Organismus durch Enzyme durch Enzyme.
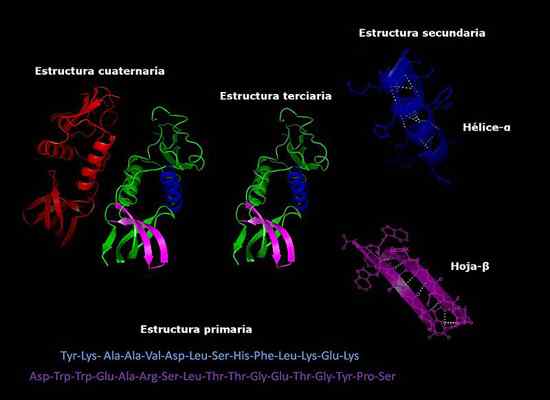
 Primäre, sekundäre, tertiäre und quaternäre Strukturen von Proteinen, dreidimensionale Konformation. Genommen und bearbeitet von: Alejandro Porto [CC BY-SA 3.0 (https: // creativecommons.Org/lizenzen/by-sa/3.0)]].
Primäre, sekundäre, tertiäre und quaternäre Strukturen von Proteinen, dreidimensionale Konformation. Genommen und bearbeitet von: Alejandro Porto [CC BY-SA 3.0 (https: // creativecommons.Org/lizenzen/by-sa/3.0)]]. Derzeit ist die Bestimmung der Zusammensetzung von Proteinen und der Reihenfolge, in der Aminosäuren (Sequenzierung) angeordnet sind. Diese Informationen werden in internationalen elektronischen Datenbanken hinterlegt, auf die über das Internet zugegriffen werden kann (unter anderem über das Internet (GenBank, PIR)).
[TOC]
Aminosäuren
Aminosäuren sind Moleküle, die eine Aminogruppe und eine Carboxysäuregruppe enthalten. Im Fall von α-Aminosäuren haben sie ein zentrales Kohlenstoffatom (Kohlenstoff α), zu dem sie zusammen sind, sowohl die Amino-Gruppe als auch die Carboxylgruppe, zusätzlich zu einem Wasserstoffatom und einer charakteristischen R-Gruppe, die als Seite bezeichnet wird Kette.
Aufgrund dieser Konfiguration von α-Kohlenstoff sind die gebildeten Aminosäuren, die als α-Aminosäuren bekannt sind, Chirale. Es gibt zwei Formen, die Spiegelbilder voneinander sind und als Enantiomere L und D bezeichnet werden.
Alle Protein der Lebewesen werden durch 20 α-Aminosäure-Konfiguration L gebildet. Die Seitenketten dieser 20 Aminosäuren sind unterschiedlich und haben eine große Vielfalt chemischer Gruppen.
Grundsätzlich können α-Aminosäuren (willkürlich) je nach Art der Seitenkette in der folgenden Weise gruppiert werden.
Aliphatische Aminosäuren
In dieser Gruppe sind sie gemäß einigen Autoren Glycine (GLI), Alanin (Flügel), Valine (Val), Leucina (Leu) und Isoleucin (ILE) enthalten. Andere Autoren sind auch Metionin (MET) und Prolin (Pro).
Kann Ihnen dienen: Phospholipide: Eigenschaften, Struktur, Funktionen, TypenAminosäuren mit Seitenketten, die Hydroxyl oder Schwefel enthalten
Es enthält die Serin (Ser), Cystein (Cys), Treonina (Thr) und auch Metionin. Nach Angaben einiger Autoren sollte die Gruppe nur Sein und THR einschließen.
Zyklische Aminosäuren
Nur durch den Prolin integriert, was, wie bereits erwähnt, von anderen Autoren unter aliphatischen Aminosäuren enthalten ist.
Aromatische Aminosäuren
Phenylalanin (PHE), Tyrosin (Tyr) und Triphafano (TRP).
Basis -Aminosäuren
Histidin (His), Lysin (Lys) und Arginina (Arg)
Saure Aminosäuren und ihre Amide
Es enthält Asparaginsäuren (ASP) und Glutamic (Glu) sowie Spargine (ASN) und Glutamin (Gln). Einige Autoren trennen die letztere Gruppe in zwei; Einerseits die von sauren Aminosäuren (die ersten beiden) und andererseits diejenigen, die Carboxylamid enthalten (die verbleibenden zwei).
Peptidverbindungen
Aminosäuren können sich durch Peptidverbindungen miteinander verbinden. Diese Verbindungen, auch Amida-Links genannt. Diese Vereinigung wird mit dem Verlust eines Wassermoleküls gebildet.
Die Vereinigung zwischen zwei Aminosäuren führt zur Bildung eines Dipéptids und wenn neue Aminosäuren nacheinander Tripid, Tetrapéptides usw. zugesetzt werden.
Die Polypeptide, die durch eine kleine Anzahl von Aminosäuren gebildet werden, erhalten den allgemeinen Namen von Oligopeptiden, und wenn die Anzahl der Aminosäuren hoch ist, werden Polypeptide aufgerufen.
Jede Aminosäure, die zur Polypeptidkette zugesetzt wird. Der Teil der Aminosäure, der die H+ oder OH- während der Union verloren hat, wird als Rest von Aminosäure bezeichnet.
Die meisten dieser Oligopeptid- und Polypeptidketten werden an einem Ende eine Amino-terminale (N-terminale) Gruppe und in der anderen ein terminales Carboxyl (C-terminal) auftreten. Darüber hinaus können sie viele ionisierbare Gruppen zwischen den lateralen Ketten des Aminosäureabfalls enthalten, die sie umfassen. Aus diesem Grund werden Polyanfolite berücksichtigt.
Kann Ihnen dienen: Flora und Fauna von Campeche: Repräsentative Arten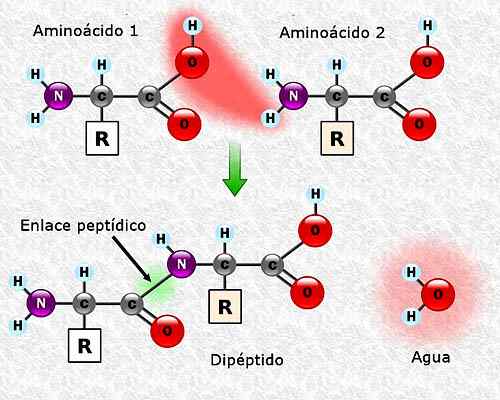 Bildung einer Peptidverbindung zwischen zwei Aminosäuren. Genommen und bearbeitet von: Alejandro Porto [CC BY-SA 3.0 (https: // creativecommons.Org/lizenzen/by-sa/3.0)]].
Bildung einer Peptidverbindung zwischen zwei Aminosäuren. Genommen und bearbeitet von: Alejandro Porto [CC BY-SA 3.0 (https: // creativecommons.Org/lizenzen/by-sa/3.0)]]. Aminosäuresequenz
Jedes Protein hat eine bestimmte Sequenz seines Aminosäureabfalls. Diese Reihenfolge ist die sogenannte Primärstruktur des Proteins.
Jedes einzelne Protein jedes Organismus ist spezifisch für die Spezies. Das heißt, das Myoglobin eines Menschen ist identisch mit dem eines anderen Menschen, hat aber kleine Unterschiede zu den Myoglobinen anderer Säugetiere.
Die Menge und Arten von Aminosäuren, die ein Protein enthält. Um die Proteine zu kennen, müssen Biochemiker zuerst jedes bestimmte Protein isolieren und reinigen, dann eine Analyse des Aminosäurehalts durchführen und schließlich seine Sequenz bestimmen.
Um Proteine zu isolieren und zu reinigen.
Die Bestimmung der in den Proteinen vorhandenen Aminosäuren erfolgt nach drei Schritten. Die erste besteht darin, die Peptidbindungen durch Hydrolyse zu brechen. Anschließend werden die verschiedenen Arten von Aminosäuren aus der Mischung getrennt; Und schließlich wird jede der erhaltenen Arten von Aminosäuren quantifiziert.
Um die Primärstruktur des Proteins zu bestimmen, können verschiedene Methoden verwendet werden; Derzeit ist die am häufigsten verwendete Methode von Edman, die im Grunde genommen aus der Markierung und Trennung der N-terminalen Aminosäure vom Rest der Kette und der Identifizierung jeder Aminosäure einzeln identifiziert wird.
Proteincodierung
Die Primärstruktur von Proteinen ist in Organismus -Genen kodiert. Genetische Informationen sind in DNA enthalten, aber für die Proteintranslation muss zuerst RNM -Moleküle transkribiert werden. Jedes Nukleotid -Triplett (Codon) codiert eine Aminosäure.
Kann Ihnen dienen: Was ist die chemische Zusammensetzung der Lebewesen??Da es 64 mögliche Codons gibt und bei der Konstruktion von Proteinen nur 20 Aminosäuren verwendet werden, kann jede Aminosäure durch mehr als ein Codon codiert werden. Praktisch alle Lebewesen verwenden dieselben Codons, um dieselben Aminosäuren zu codieren. Daher wird der genetische Code als fast universelle Sprache angesehen.
In diesem Code werden Codons verwendet, um die Polypeptid -Translation zu starten und zu stoppen. Die Abschlusscodons codieren keine Aminosäure, sondern stoppen die Übersetzung in die Kette C-terminal und werden durch die UAA-, UAG- und UGA-Tripletts dargestellt.
Andererseits fungiert das Aug -Codon normalerweise als Startsignal und codiert auch das Metionin.
Nach der Übersetzung können Proteine eine gewisse Verarbeitung oder Änderung wie kurze Medierbarkeit erleiden, um seine endgültige Konfiguration zu erreichen.
Verweise
- C.K. Mathews, k.UND. Van Hold & k.G. Ahern. 2002. Biochemerie. 3th Auflage. Benjamin / Cummings Publishing Company, Inc.
- Murray, p. Mayes, d.C. Granner & v.W. Rodwell. Neunzehn sechsundneunzig. Harpers Biochemerie. Appleton & Lange
- J.M. Berg, j.L. Tymoczko & l. Stryer (SF). Biochemerie. 5th Auflage. W. H. Freeman und Gesellschaft.
- J. Koolman & k.-H. Roehm (2005). Atlas der biochemischen Farbe. 2Nd Auflage. Thieme.
- ZU. Lehninger (1978). Biochemie. Omega -Ausgaben, s.ZU.
- L. Stryer (1995). Biochemerie. W.H. Freeman und Company, New York.
- « Avogadro -Zahlengeschichte, Einheiten, wie es berechnet wird, verwendet, verwendet
- Exonuklease -Eigenschaften, Struktur und Funktionen »

