Sekundärstruktur von Eigenschaftenproteinen

- 2199
- 302
- Jasmine Kupprion
Der Sekundäre Proteinstruktur Es ist der Name, der die Konformation definiert, die lokal von einigen Teilen der Polypeptidkette gefaltet ist. Diese Struktur besteht aus mehreren Mustern, die regelmäßig wiederholt werden.
Es gibt viele Möglichkeiten, wie die Proteineketten gefaltet sind. Es sind jedoch nur wenige dieser Formen sehr stabil. In der Natur sind die häufigsten Formen, die Proteine erwerben. Diese Strukturen können durch Verbindungswinkel beschrieben werden ψ (Psi) und φ (PHI) von Aminosäureabfällen.
 Schema und Modell von Kugeln und Stäben der Alfa -Helix von Proteinen (Sekundärstruktur). Genommen und bearbeitet von: Alejandro Porto [CC BY-SA 3.0 (https: // creativecommons.Org/lizenzen/by-sa/3.0)]].
Schema und Modell von Kugeln und Stäben der Alfa -Helix von Proteinen (Sekundärstruktur). Genommen und bearbeitet von: Alejandro Porto [CC BY-SA 3.0 (https: // creativecommons.Org/lizenzen/by-sa/3.0)]]. Die zwischen den lateralen Ketten von Aminosäureabfällen festgelegten Wechselwirkungen können dazu beitragen, die Sekundärstruktur von Proteinen zu stabilisieren oder im Gegenteil zu destabilisieren. Die Sekundärstruktur kann in der Konstitution vieler faseriger Proteine beobachtet werden.
[TOC]
Geschichte
In den Jahrzehnten der 30er Jahre des letzten Jahrhunderts stellte William Atsbury, der mit X -Rays arbeitete, fest.
Basierend auf diesen Ergebnissen und mit der Kenntnis der Bedeutung von Wasserstoffbindungen für die Ausrichtung der polaren Gruppen der Peptidbindungen, William Pauling und Mitarbeiter bestimmte sie folglich die möglichen regelmäßigen Konformationen, die die Proteine besitzen könnten.
Pauling und seine Mitarbeiter haben in den 1950er Jahren mehrere Postulate errichtet, die in den Verbindungen der Polypeptidketten erfüllt werden mussten, einschließlich und in erster Linie, dass zwei Atome sich nicht in einer Entfernung weniger als ihre Entfernung von ihrem jeweiligen Abstand nähern mussten können Funkgeräte von Van der Waals.
Sie gaben auch an, dass nicht -kalvalente Verbindungen erforderlich sind, um die Faltung der Ketten zu stabilisieren.
Kann Ihnen dienen: sexuelle FortpflanzungBasierend auf diesen Postulaten und Vorkenntnissen und unter Verwendung molekularer Modelle gelang es ihnen, einige regelmäßige Konformationen von Proteinen zu beschreiben, einschließlich, die anschließend gezeigt wurden, dass sie die häufigsten in der Natur waren, wie z. B. Propeller α und Lamina β β β.
Propeller α
Es ist die einfachste Sekundärstruktur, bei der die Polypeptidkette in einer gerollten und verdichteten Form um eine imaginäre Achse angeordnet ist. Zusätzlich heben sich die Seitenketten jeder Aminosäure von diesem helikalen Skelett ab.
Aminosäuren sind in diesem Fall so angeordnet, dass sie Verbindungswinkel haben ψ Von -45 ° bis -50 ° und und φ von -60 °. Diese Winkel beziehen sich auf die Verbindung zwischen α -Kohlenstoff und dem Sauerstoff der Carbonyl und der Bindung zwischen dem Stickstoff und dem α -Kohlenstoff jeder Aminosäure.
Darüber hinaus haben Wissenschaftler festgestellt, dass für jede α -Propeller -Wende 3,6 Aminosäureabfälle vorgestellt werden und dass diese Kurve immer Dextrogyry in Proteinen ist. Der α-Propeller ist nicht nur die einfachste Struktur, sondern auch die vorherrschende Form in α-Queratinas und etwa 25% der Aminosäuren von globulären Proteinen übernehmen diese Struktur.
Der α -Propeller wird dank der Tatsache stabilisiert, dass er zahlreiche Wasserstoffbrücken aufweist. Somit werden in jeder Propellerwende drei oder vier Links dieses Typs festgelegt.
In den Wasserstoffbrücken ist der Stickstoff einer Peptidbindung und das Sauerstoffatom der Carbonylgruppe der nachfolgenden Aminosäure in Richtung der Amino-terminalen Seite dieser Kette.
Wissenschaftler haben gezeigt, dass ein α-Propeller mit Polypeptidketten gebildet werden kann, die durch L- oder D-Aminosäuren gebildet werden, mit der Bedingung, dass alle Aminosäuren die gleiche Stereoisomera-Konfiguration haben. Zusätzlich können natürliche L-EMinosäuren α-Droords mit sowohl rechts als auch links bilden.
Kann Ihnen dienen: Immunglobulin DAllerdings können nicht alle Polypeptide einen stabilen α -Propeller bilden, da ihre Primärstruktur die Stabilität davon beeinflusst. Die R -Ketten einiger Aminosäuren können die Struktur destabilisieren und die Bildung der Propeller α verhindern.
Β -Blatt
Im β -Blatt oder gefalteten β -Blatt hat jeder der Aminosäurerabfälle eine Rotation um 180 ° in Bezug auf den vorhergehenden Aminosäurer Rest. Auf diese Weise wird es als Ergebnis erhalten, dass das Skelett der Polypétid -Kette und in einem Zickzack- oder Akkordeonformular verlängert wird.
Mit powded -ähkordförmige Polypeptidketten können nebeneinander platziert werden und lineare Wasserstoffbrücken zwischen beiden Ketten produzieren.
Zwei benachbarte Polypeptidketten können parallel angeordnet werden, dh beide können in der Amino -Carboxyl -Richtung ausgerichtet werden und bilden das parallele β -Blatt; o Sie können sich in entgegengesetzte Richtungen befinden und dann das β -Antiparalla -Blatt bilden.
Die lateralen Ketten benachbarter Aminosäureabfälle heben sich in entgegengesetzten Richtungen vom Skelett der Kette ab und führen zu einem abwechselnden Muster. Einige Proteinstrukturen begrenzen die Arten von Aminosäuren von β -Strukturen.
Zum Beispiel sind in dicht verpackten Proteinen kurzkettige Aminosäuren wie Glycin und Alanin auf ihren Kontaktflächen häufiger.
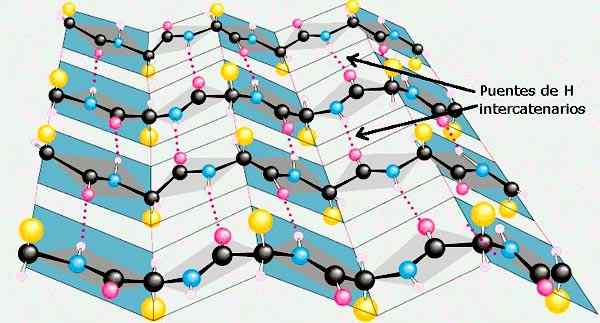 Das β -Blatt der Sekundärstrukturen von Proteinen. Genommen und bearbeitet von: Preston Manor School + JFL [CC BY-SA 3.0 (https: // creativecommons.Org/lizenzen/by-sa/3.0)]].
Das β -Blatt der Sekundärstrukturen von Proteinen. Genommen und bearbeitet von: Preston Manor School + JFL [CC BY-SA 3.0 (https: // creativecommons.Org/lizenzen/by-sa/3.0)]]. Andere Konformationen der Sekundärstruktur
Helix 310
Diese Struktur wird durch die Präsentation von 3 Aminosäureabfällen pro Runde gekennzeichnet. Diese Struktur wurde in einigen Proteinen beobachtet, aber sie ist nicht sehr häufig in der Natur.
Helix π
Diese Struktur hat inzwischen 4,4 Aminosäureabfälle aus Spiralwende und eine Wasserstoffverbindungsschleife von 16 Elementen. Obwohl diese Konfiguration sterisch möglich ist, wurde sie in der Natur nie beobachtet.
Kann Ihnen dienen: Dextrose -Kartoffelagar: Fundament, Vorbereitung und VerwendungDie mögliche Ursache dafür kann sein hohles Zentrum sein, das zu groß ist, um die Leistung der Van der Waals -Kräfte zu ermöglichen, die dazu beitragen würden.
Superscundaria -Struktur
Supersekundäre Strukturen sind Kombinationen von Sekundärstrukturen von α- und gefalteten β -β -Blättern. Diese Strukturen können in vielen kugelförmigen Proteinen auftreten. Es gibt unterschiedliche mögliche Kombinationen, von denen jede besondere Eigenschaften aufweist.
Einige Beispiele für SuperSecundarias -Strukturen sind: die Einheit βαβ, bei dem zwei parallele β -Blätter durch ein α -Propellersegment miteinander verbunden sind; Die Einheit αα, gekennzeichnet durch zwei aufeinanderfolgende αices, aber durch ein nicht helikales Segment getrennt, das mit der Kompatibilität seiner Seitenketten verbunden ist.
Mehrere β -Blätter können sich auf sich zurückziehen, die eine Konfiguration von geben Fass β, während ein Antipaallala -β -Blatt darauf zurückgezogen wurde, ob es eine SuperSecundaria -Struktur nennt Griechischer Schlüssel.
Verweise
- C.K. Mathews, k.UND. Van Hold & k.G. Ahern (2002). Biochemerie. 3. Auflage. Benjamin / Cummings Publishing Company, Inc.
- R.Murray, p. Mayes, d.C. Granner & v.W. Rodwell (1996). Harpers Biochemerie. Appleton & Lange.
- J.M. Berg, j.L. Tymoczko & l. Stryer (2002). Biochemerie. 5. Ausgabe. W. H. Freeman und Gesellschaft.
- J.Koolman & k.-H. Roehm (2005). Atlas der biochemischen Farbe. 2. Auflage. Thieme.
- ZU. Lehninger (1978). Biochemie. Omega -Ausgaben, s.ZU.
- T. McKee & J.R. McKee (2003). Biochemie: die molekulare Grundlage des Lebens. 3Rd Auflage. Die McGraw-Hiii Companies, Inc.
- « Elastische Schocks in einer Dimension, besonderen Fällen, Übungen
- Aktuelle Werteigenschaften, Formeln und Beispiele »

