Tertiärstruktur der Hauptmerkmale Merkmale

- 3340
- 141
- Joe Hartwig
Der Tertiärstruktur von Proteinen Es ist die dreidimensionale Konformation, die Polypeptidketten beim Falten auf sich selbst erwerben. Diese Konformation erscheint durch Wechselwirkungen zwischen den lateralen Ketten des Aminosäureabfalls des Polypeptids. Seitenketten können unabhängig von ihrer Position im Protein interagieren.
Da es von den Wechselwirkungen zwischen R -Gruppen abhängt, zeigt die Tertiärstruktur nicht repetitive Aspekte der Kette, da diese Gruppen für jeden Aminosäurer Rest unterschiedlich sind. Die sekundäre Struktur hingegen hängt von Carboxyl- und Aminogruppen ab, die in allen Aminosäuren vorhanden sind.
 Tertiärstruktur des Kinasephosphataseproteins mit Sekundärstrukturen in Alpha und Beta -Blatt. Genommen und bearbeitet von: A2-33. Modifiziert durch Alejandro Porto. [CC BY-SA 3.0 (https: // creativecommons.Org/lizenzen/by-sa/3.0)]].
Tertiärstruktur des Kinasephosphataseproteins mit Sekundärstrukturen in Alpha und Beta -Blatt. Genommen und bearbeitet von: A2-33. Modifiziert durch Alejandro Porto. [CC BY-SA 3.0 (https: // creativecommons.Org/lizenzen/by-sa/3.0)]].
Einige Autoren schlagen vor, dass faserige Proteine eine einfache Tertiärstruktur haben, aber andere Autoren weisen darauf hin, dass diese Struktur für globuläre Proteine typisch ist.
[TOC]
Faserproteine
In faserigen Proteinen sind Polypeptidketten in Form langer Filamente oder langen Blätter angeordnet. Sie bestehen im Allgemeinen aus einer einzigartigen Art von Sekundärstruktur. Diese Sekundärstruktur ist in den meisten Fällen wichtiger als die Tertiärstruktur bei der Bestimmung der Proteinform.
Seine biologische Funktion ist strukturell, verleiht den Organen und Strukturen, in denen sie gefunden werden, Stärke und/oder Elastizität, während sie sie zusammenhalten. Alle fibrösen Proteine sind in Wasser unlöslich, da sie große Menge an hydrophoben Aminosäuren vorhanden sind.
Unter diesen faserigen Proteinen befinden sich Keratine und Kollagen. Erstere werden in konjunktiven Stoffen und in Strukturen wie Haaren, Nägeln (α-Queratinas), Skalen und Federn (β-Cheatine) gefunden. Kollagen ist unter anderem in Knochen, Sehnen und Haut vorhanden.
α-Queratinas
Diese Proteine sind Teil der sogenannten Zwischenfilamente Proteine, die eine wichtige Rolle im Zytoskelett mehrzelliger Organismen spielen. Darüber hinaus sind sie der Hauptbestandteil von Haaren, Nägeln, Wolle, Hörnern, Hufen und einer der wichtigsten Tierhautproteine.
Kann Ihnen dienen: Kinyoun -FärbungDie Struktur des Moleküls ist ein α -Propeller. Zwei Stränge von α-Queratin können parallel angeordnet werden und schrieb sich mit ihren r-hydrophoben Gruppen, die zwischen ihnen interagieren. Auf diese Weise wird eine Superhelik- oder Ballstruktur mit Wicklung nach links erzeugt.
Die Tertiärstruktur von α-Keratin ist einfach und wird von der Sekundärstruktur von α-Helix dominiert. Andererseits ist auch die quaternäre Struktur vorhanden.
β-Queratinas
Die Primärstruktur ähnelt der von α-Queratinas, aber ihre sekundäre Struktur wird von β-Blättern dominiert. Sie sind der Hauptbestandteil der Waagen der Reptilien und der Federn der Vögel.
Kollagen
Dieses Protein kann mehr als 30% der gesamten Proteinmasse einiger Tiere repräsentieren. Es kommt unter anderem in Knorpel, Knochen, Sehnen, Hornhaut und Haut vor.
Die sekundäre Struktur des Kollagen. Drei Levogyöse Propellerketten (α).
Tropocollagen -Moleküle kommen zusammen, um eine Kollagenfaser mit großem Widerstand zu bilden, höher als Stahl und vergleichbar mit Kupfer mit hohem Widerstand.
Andere faserige Proteine
Andere Arten von faserigen Proteinen sind Fibroin und Elastin. Die erste von ihnen wird durch β -Blätter gebildet, die hauptsächlich von Glycina, Alanin und Serin bestehen.
Die lateralen Ketten dieser Aminosäuren sind klein, sodass sie eng verpackt werden können. Das Ergebnis ist eine Faser, die sowohl sehr resistent als auch sehr unpasst ist.
Kann Ihnen dienen: Phosphatpuffer (PBS): Fundament, Vorbereitung und VerwendungIm Elastin ersetzt das Valin die Serin unter seinen Hauptbestandteilen Aminosäuren. Im Gegensatz zu Fibroin ist Elastin sehr erweiterbar, daher der Name. In der Konstitution des Moleküls handelt Lysin auch, die an Kreuzverschlüssen teilnehmen können, die es Elastin ermöglichen, seine Form wiederzugewinnen.
Globuläre Proteine
Globuläre Proteine sind im Gegensatz zu faserig löslich und haben im Allgemeinen verschiedene Arten von Sekundärstrukturen. In diesen sind jedoch wichtigere dreidimensionale Konformationen, die sie beim Falten auf sich selbst erwerben (Tertiärstruktur).
Diese besonderen dreidimensionalen Konformationen geben jedem Protein eine spezifische biologische Aktivität. Die Hauptfunktion dieser Proteine ist wie bei Enzymen regulatorisch.
Eigenschaften der tertiären Struktur von kugelförmigen Proteinen
Die tertiäre Struktur von kugelförmigen Proteinen hat einige wichtige Eigenschaften:
- Globuläre Proteine sind dank der Verpackung kompakt, wenn sich die Polypeptidkette faltet.
- Der entfernte Aminosäureabfall in der Primärstruktur von Polypeptidketten ist nahe und kann aufgrund der Faltung miteinander interagieren.
- Größere globuläre Proteine (mehr als 200 Aminosäuren) können mehrere kompakte Segmente haben, die zwischen ihnen und mit bestimmten Funktionen unabhängig sind, und jede dieser Segmente wird als Domäne bezeichnet. Eine Domäne kann zwischen 50 und 350 Aminosäureabfällen haben.
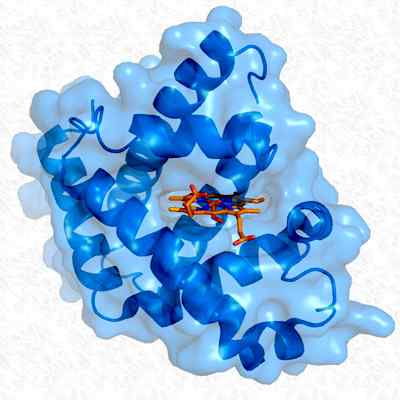 Tertiärstruktur von Myoglobin. Genommen und bearbeitet von: Thomas Splettstoesser. Modifiziert durch Alejandro Porto. [CC BY-SA 3.0 (https: // creativecommons.Org/lizenzen/by-sa/3.0)]].
Tertiärstruktur von Myoglobin. Genommen und bearbeitet von: Thomas Splettstoesser. Modifiziert durch Alejandro Porto. [CC BY-SA 3.0 (https: // creativecommons.Org/lizenzen/by-sa/3.0)]].
Allgemeine Regeln für die Faltung globaler Proteine
Wie bereits erwähnt, haben Proteine bestimmte Faltformen, die ihnen auch bestimmte Eigenschaften verleihen. Diese Faltung ist nicht zufällig und wird sowohl durch die primäre als auch durch die sekundäre Struktur und durch einige nichtkovalente Interaktionen bevorzugt. Es gibt auch einige physikalische Einschränkungen für die Faltung, sodass einige Regeln formuliert wurden:
Kann Ihnen dienen: primäre lymphoide Organe- Alle globulären Proteine haben Verteilungsmuster definiert, wobei hydrophobe Gruppen in das Molekül und hydrophiler Abfall in der äußeren Schicht in der Außenschicht gerichtet sind. Dafür sind mindestens zwei Schichten der Sekundärstruktur erforderlich. Die β-α-β-Schleife und der α-α-Scheitelpunkt können diese beiden Schichten beitragen.
- Die β -Blätter sind im Allgemeinen in einer in Levogira gerollten Form angeordnet.
- In einer Polypeptidkette können unterschiedliche Kurven auftreten, um sich von einer sekundären zu einer anderen Struktur zu bewegen, wie z.
- Globuläre Proteine haben α-, β -Blätter, unregelmäßig strukturierte Wendungen und Segmente.
Protein -Denaturierung
Wenn ein Protein seine native (natürliche) dreidimensionale Struktur verliert, verliert es seine biologische Aktivität und die meisten seiner spezifischen Eigenschaften. Dieser Prozess wird als Denaturierung bezeichnet.
Denaturierung kann auftreten, wenn sich die natürlichen Umweltbedingungen ändern, beispielsweise durch unterschiedliche Temperatur oder pH. Der Prozess ist in vielen Proteinen irreversibel; Andere können jedoch ihre natürliche Struktur spontan wiederherstellen, indem sie normale Umweltbedingungen wiederherstellen.
Verweise
- C.K. Mathews, k.UND. Van Hold & k.G. Ahern (2002). Biochemerie. 3. Auflage. Benjamin / Cummings Publishing Company, Inc.
- R.Murray, p. Mayes, d.C. Granner & v.W. Rodwell (1996). Harpers Biochemerie. Appleton & Lange.
- J.M. Berg, j.L. Tymoczko & l. Stryer (2002). Biochemerie. 5. Ausgabe. W. H. Freeman und Gesellschaft.
- W.M. Becker, l.J. Kleinsmith & J. Hardin (2006) Welt der Zelle. 6. Ausgabe. Pearson Education Inc.
- ZU.Lehninger (1978). Biochemie. Omega -Ausgaben, s.ZU.
- T. McKee & J.R. McKee (2003). Biochemie: die molekulare Grundlage des Lebens. 3. Auflage. Die McGraw-Hiii Companies, Inc.
- « Fermionische Kondensateigenschaften, Anwendungen und Beispiele
- Dodecil Natriumsulfat (SDS) Struktur (SDS), Eigenschaften, verwendet »

