Etano
- 4684
- 1230
- Said Ganzmann
 Estano -Struktur
Estano -Struktur Was ist Ethan?
Er Etano Es ist eine einfache Kohlenwasserstoff für Formel -C2H6 Mit einer farblosen und Toilettengas Natur, die eine sehr wertvolle und diversifizierte Verwendung in der Ethylensynthese hat. Darüber hinaus ist es eine der Landgase, die auch in anderen Planeten und Sternenkörpern rund um das Sonnensystem erkannt wurde. Es wurde 1834 vom Wissenschaftler Michael Faraday entdeckt.
Unter der großen Anzahl von organischen Verbindungen, die durch Kohlenstoff- und Wasserstoffatome (als Kohlenwasserstoffe bekannt) gebildet werden, gibt es solche, die sich in einem gasförmigen Zustand in Temperaturen und Umweltdrucks befinden, die in zahlreichen Branchen stark eingesetzt werden.
Diese stammen normalerweise aus der gasförmigen Mischung, die als "Erdgas" bezeichnet wird, ein Produkt mit hohem Wert für die Menschheit, und bilden unter anderem Methan-, Ethan-, Propan- und Butan -Typen. Qualifikation gemäß der Menge an Kohlenstoffatomen in seiner Kette.
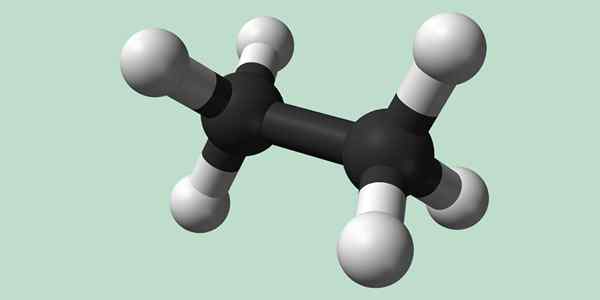
Chemische Struktur von Ethan
Estano ist ein Formel -C -Molekül2H6, Typischerweise als Vereinigung von zwei Methylgruppen (-ch3) Um den Kohlenwasserstoff einer einfachen Kohlenstoffkohlenstoffbindung zu bilden. Es ist auch die einfachste organische Verbindung nach Methan, die sich selbst darstellt:
H3C-ch3
Kohlenstoffatome in diesem Molekül haben eine Hybridisierung des SP -Typs3, Molekulare Bindungen haben also eine freie Rotation.
Es gibt auch ein intrinsisches Phänomen von Etano, das auf der Rotation seiner molekularen Struktur und der Mindestenergie basiert, die zur Herstellung einer 360 -Grad -Verbindungsrotation erforderlich ist, die Wissenschaftler "Etano Barrera" bezeichnet haben.
Aus diesem Grund Ethan.
 Chemische Struktur von Ethan. Quelle: Wikimedia Commons
Chemische Struktur von Ethan. Quelle: Wikimedia Commons Synthese von Ethan
Estano kann leicht aus der Kolbe -Elektrolyse synthetisiert werden, eine organische Reaktion, bei der zwei Schritte auftreten: eine elektrochemische Decarboxylierung (Entfernung der Carboxylgruppe und Befreiung von Kohlendioxid) von zwei Carboxinsäuren und der Kombination der Produkte, um eine kovalente Bindung zu bilden.
In ähnlicher Weise führt die Essigsäurelektrolyse zur Bildung von Ethan und Kohlendioxid, und diese Reaktion wird verwendet, um das erste zu synthetisieren.
Die Oxidation von Essigsäureanhydrid durch die Wirkung von Peroxiden, ein Konzept, das der Elektrolyse von Kolbe ähnelt, führt ebenfalls zur Bildung von Ethan.
Kann Ihnen dienen: Beiträge von Chemie zur MenschheitAuf die gleiche Weise kann es durch einen Verflüssigungsprozess effizient von Erdgas und Methan getrennt werden, wobei es kryogene Systeme verwendet, um dieses Gas zu erfassen und es von Gemischen mit anderen Gasen zu trennen.
Der Turbo -Expansionsprozess ist der Favorit für diese Rolle: Das Gasgemisch wird durch eine Turbine hergestellt, die eine Expansion von IT erzeugt, bis seine Temperatur unter -100 ° C fällt.
Bereits zu diesem Zeitpunkt können die Komponenten des Gemisches differenziert werden, so.
Estano -Eigenschaften
Estano wird in der Natur als Toilette und farbloses Gas für Standarddrücke und Temperaturen (1 atm und 25 ° C) präsentiert. Es hat einen Siedepunkt von -88,5 ° C und einen Fusionspunkt von -182,8 ° C. Darüber hinaus wird es nicht durch die Exposition gegenüber starken Säuren oder Basen beeinflusst.
Löslichkeit von Ethan
Etano -Moleküle sind symmetrische Konfiguration und haben schwache Anziehungskräfte, die sie zusammenhalten, die als Dispersionskräfte bezeichnet werden.
Wenn Ethane versucht, sich in Wasser aufzulösen.
Aus diesem Grund ist die Löslichkeit von Ethan erheblich niedrig und steigt leicht an, wenn der Systemdruck steigt.
Kristallisation von Ethan
Estano kann verfestigt werden, was mit kubischen kristallinen Struktur instabile Ethankristalle macht.
Mit einer Temperaturabnahme über -183,2 ° C wird diese Struktur monoklin und erhöht die Stabilität ihres Moleküls.
Verbrennung von Ethan
Dieser Kohlenwasserstoff kann, selbst wenn sie nicht weit verbreitet sind, in Verbrennungsprozessen verwendet werden, um Kohlendioxid, Wasser und Wärme zu erzeugen, was wie folgt dargestellt wird:
2 c2H6 + 72 → 4co2 + 6h2O + 3120 kJ
Es besteht auch die Möglichkeit, dieses Molekül ohne einen überschüssigen Sauerstoff zu verbrennen, der als "unvollständige Verbrennung" bezeichnet wird und die zur Bildung von amorphem Kohlenstoff und Kohlenmonoxid in einer unerwünschten Reaktion führt, gemäß der Menge des angelegten Sauerstoffs:
Kann Ihnen dienen: Sterole: Struktur, Funktionen und Beispiele2 c2H6 + 32 → 4c + 6h2Oder + Wärme
2 c2H6 + 42 → 2c + 2co + 6h2Oder + Wärme
2 c2H6 + 52 → 4CO + 6H2Oder + Wärme
In diesem Bereich erfolgt die Verbrennung durch eine Reihe von readikalen Reaktionen, die in Hunderten verschiedener Reaktionen nummeriert sind. Zum Beispiel können in unvollständigen Verbrennungsreaktionen Verbindungen wie Formaldehyd, Acetaldehyd, Methan, Methanol und Ethanol gebildet werden.
Dies hängt von den Bedingungen ab, unter denen die Reaktion und die Reaktionen von freien Radikalen auftreten. Ethylen kann sich auch bei hohen Temperaturen (600-900 ° C) bilden, was ein stark gewünschtes Produkt nach Industrie ist.
Estano in der Atmosphäre und in himmlischen Körpern
Estano ist in der Atmosphäre des Planeten Erde in Spuren vorhanden, und es wird vermutet, dass der Mensch diese Konzentration verdoppelt hat, seit er begann, industrielle Aktivitäten zu praktizieren.
Wissenschaftler sind der Ansicht, dass ein großer Teil des gegenwärtigen Vorhandenseins von ETA in der Atmosphäre auf die Verbrennung fossiler Brennstoffe zurückzuführen ist, obwohl die weltweite Emission von Ethan seit der Verbesserung der Lutita -Gasproduktionstechnologien fast zur Hälfte abgenommen hat (eine Erdgasquelle), die die Lutita -Gasproduktionstechnologien (eine Erdgasquelle) waren (eine Erdgasquelle).
Diese Spezies tritt auch natürlich durch die Wirkung von Sonnenstrahlen auf atmosphärisches Methan auf, das ein Ethanmolekül rekombiniert und bildet.
Auf der Oberfläche von Titan, einem von Saturn -Monden, befindet sich ein Ethan im flüssigen Zustand. Dies wird in größerer Menge am Vid Flumina -Fluss dargestellt, der mehr als 400 Kilometer zu einem seiner Meere fließt. Diese Verbindung wurde auch an Kometen und auf der Oberfläche von Pluto belegt.
Verwendung von Ethan
Ethylenproduktion
Die Verwendung von Ethan basiert hauptsächlich auf der Ethylenproduktion, dem organischen Produkt der größeren Verwendung in der Weltproduktion, durch einen Prozess, der als Steam -Stufe bekannt ist.
Dieser Prozess besteht darin, ein verdünntes Ethan zu verabschieden.
Die Reaktion tritt bei einer extrem hohen Temperatur (zwischen 850 und 900 ° C) auf. Bei höheren Temperaturen wird mehr Ethylen erzeugt.
Kann Ihnen dienen: Neon: Geschichte, Eigenschaften, Struktur, Risiken, verwendetGrundlegende chemische Bildung
Etano wurde auch als Hauptkomponente bei der Bildung grundlegender Chemikalien untersucht. Oxidative Chlorierung ist eines der Prozesse, die zum Erhalten von Vinylchlorid (eine PVC -Komponente) angesprochen wurden, wodurch andere weniger wirtschaftlich und komplizierter ersetzt werden.
Kältemittel
Schließlich wird Ethan als Kältemittel in gemeinsamen kryogenen Systemen verwendet, die auch Kapazitäten des Einfrierens kleiner Proben im Labor zur Analyse zeigen.
Es ist ein sehr guter Ersatz für Wasser, das mehr braucht, um die empfindlichen Proben abzukühlen und auch die Bildung von schädlichen Eiskristallen erzeugen kann.
Risiken von Ethan
-Estano hat die Fähigkeit, sich zu entzünden, vor allem, wenn es sich in die Luft anschließt. Ein Prozentsatz von 3,0 bis 12,5% Ethanvolumen in der Luft kann eine explosive Mischung gebildet werden.
-Es kann den Sauerstoff in der Luft einschränken, in der es gefunden wird, und aus diesem Grund ist es einen Risikofaktor für Erstickung für Personen und Tiere, die anwesend und exponiert sind.
-Das Ethan in gefrorener Flüssigkeitsform kann die Haut ernst.
-Die Dämpfe von flüssigem Ethan sind schwerer als Luft und Konzentrat auf dem Boden. Dies kann ein Zündrisiko darstellen, das eine Kettenverbrennungsreaktion erzeugen kann.
-Die Einnahme von Etano kann Übelkeit, Erbrechen und innere Blutungen verursachen. Inhalation führt zusätzlich zum Ersticken Kopfschmerzen, Verwirrung und Humorveränderung aus. Der Tod durch Herzstillstand ist bei hohen Ausstellungen möglich.
-Es repräsentiert ein Treibhausgas, das zusammen mit Methan und Kohlendioxid zur globalen Erwärmung und zum Klimawandel beiträgt, das durch menschliche Verschmutzung erzeugt wird. Zum Glück ist es weniger häufig und dauerhaft als Methan und absorbiert weniger Strahlung als diese.
Verweise
- Britannica, e. (S.F.). Ethan. Aus Britannica erhalten.com
- Nes, g. V. (S.F.). Einkristallstrukturen und Elektronendichteverteilungen von Ethan, Ether und Acetylen. Teppich erholt.Nl
- Standorte, g. (S.F.). Ethane: Quellen und Waschbecken. Von Standorten erhalten.Google.com
- Softschools (s.F.). Ethanformel. Von Softschools geborgen.com
- Wikipedia (s.F.). Ethan. Erhalten von in.Wikipedia.Org

