Europio -Struktur, Eigenschaften, erhalten, verwendet, verwendet

- 1220
- 168
- René Riediger
Er Europio Es handelt sich. Dies ist das reaktivste für Seltenerdmetalle und verglichen Lithium, Kalzium und Barium, weshalb seine mineralogische Diffusion sehr verstreut ist.
Es ist eines der seltensten und teursten Metalle, da alle Verfahren durchgeführt werden müssen, um frei von Unreinheiten zu extrahieren. Physisch zeigt es ein grau goldenes Leuchten, das durch seine schnelle Oxidation verursacht wird, es ist kaum der Luft ausgesetzt. Daher ist es selten möglich, es mit seiner authentischen silbernen Farbe zu speichern.
 Oxidiertes Europium. Quelle: Hi-Res-Bilder von chemischen Elementen/CC von (https: // creativeCommons.Org/lizenzen/bis/3.0)
Oxidiertes Europium. Quelle: Hi-Res-Bilder von chemischen Elementen/CC von (https: // creativeCommons.Org/lizenzen/bis/3.0) Das Europium ist so reaktiv, dass es in Ampullen oder versiegelten Behältern unter inerten Argonatmosphäre gelagert werden muss. Sogar in Mineralöl getaucht wird durch den kleinen gelösten Sauerstoff oxidiert.
Ein herausragendes Merkmal des Europiums ist seine Lumineszenz, insbesondere in seinen Verbindungen mit Oxidationszahl +3, wie die USA2ENTWEDER3, Dies ist ein rotes Phosphor, der in unendlich elektronischen Geräten und auch auf Euro -Tickets angewendet wird, um deren Fälschungen zu verhindern.
[TOC]
Entdeckung von Europio
Die Entdeckung des Europiums wurde im gesamten neunzehnten Jahrhundert und in verschiedenen Ländern (Schweden, Deutschland und Schweiz) des europäischen Kontinents in Teilen geschaffen. Europiumionen waren schwer identifizieren.
Daher zogen die Identifizierung und Isolierung all dieser Metalle das Europium als Unreinheit ohne Charakterisierung. Zum Beispiel hatte die Isolation einer reinen Probe von Cerio 1839 durch Carl Gustav Mosander als Produkt die Anerkennung anderer neuer Elemente: Lantano und Didimio.
Während der Untersuchung des Didimio und der Schlussfolgerung wurde es wirklich aus einer Mischung aus anderen Elementen (Proseodym und Neodym) bestand, erschien der Samario, das 1879 von Paul èmile Lecoq gefunden wurde.
Kann Ihnen dienen: Aluminiumhydrid (Alh3): Struktur, Eigenschaften, verwendetSpäter, im Jahr 1886, reinigte der Schweizer Chemiker Jean Charles Galissard Samarium -Proben, die Gadolinio fanden. Lecoq für 1892 hatte bereits die Spektren von Gadolinio und das eines anderen neuen Elements untersucht.
Fünfzehn Jahre später, im Jahr 1901.
Chemische Struktur des Europiums
Europiumatome bleiben dank der metallischen Bindung vereint und beteiligen sich an den Elektronen ihrer 4F- und 6S -Orbitale. Infolge seiner elektronischen Eigenschaften, Atomradios und der Art der Verpackung nimmt das Europium eine kubische kristalline Struktur ein, die auf dem Körper (BCC) zentriert ist, was einer der am wenigsten dichten ist.
Es gibt keine bibliografischen Quellen, die ein anderes Polymorph für das Europio erwähnen, abgesehen von der BCC -Phase in anderen Temperaturbereichen. Aber unter unterschiedlichem Druck.
Zum Beispiel nimmt das Europium, das einem Druck nahe 18 GPa unterzogen wurde, eine kompakte hexagonale Struktur an und verwandelt.5 GPA.
Elektronische Konfiguration
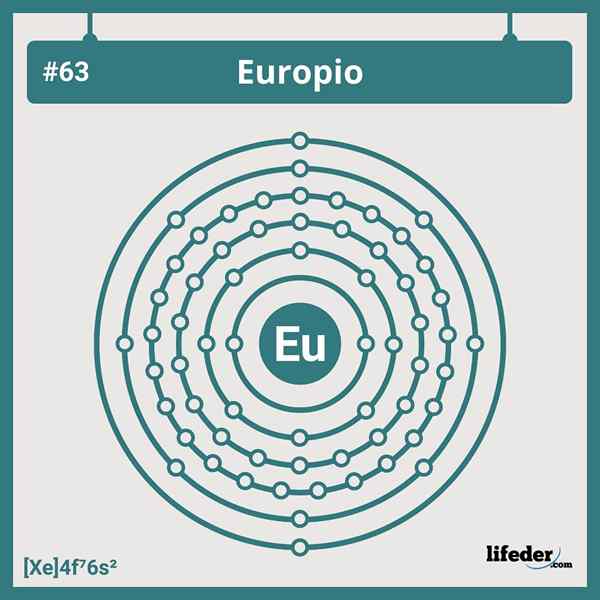 Elektronische Europiumkonfiguration
Elektronische Europiumkonfiguration Die abgekürzte elektronische Konfiguration des Europiums lautet:
[Xe] 6s24f7
In Position oder Gruppe 7 der Lantanid -Serie ist es sieben Elektronen, die ihre 4F -Orbitale belegen. Und daher entspricht es keiner der Abweichungen, die wir in den elektronischen Konfigurationen für die Elemente der Periodenzüchter finden.
Europio -Eigenschaften
Aussehen
Silber weißes Metall, weiche Härte ähnlich der des Bleis und das wird golden, wenn es der Luft ausgesetzt ist, und bedeckt eine Oxid- und Carbonatschicht.
Ordnungszahl
63
Molmasse
151.96 g/mol
Schmelzpunkt
826 ºC
Siedepunkt
1529 ºC
Dichte
Solid: 5.264 g/cm3
Am Schmelzpunkt: 5.13 g/cm3
Oxidationszustände
Die Hauptoxidationszustände des Europiums sind +2 (EU2+) und +3 (EU3+), Sein +1 (EU+) Die am wenigsten gewöhnliche der drei.
Kann Ihnen dienen: Polarer kovalenter Link: Merkmale und BeispieleIonisationsenergien
-Erstens: 547.1 kJ/mol (EU+ gasförmig)
-Zweitens: 1085 kJ/mol (EU2+ gasförmig)
-Dritter: 2404 KJ/Mol (EU3+ gasförmig)
Elektronegativität
1.2 auf der Paulingskala.
Magnetische Ordnung
Paramagnetisch
Reaktivität
Die Reaktivität des Europiums ist vergleichbar mit der von Lithium und daher das reaktivste Metall von Seltenen Erden. Reagieren Sie beispielsweise schnell mit Wasser, um sein entsprechendes Hydroxid EU (OH) zu bilden3, Gelb, die im Gegensatz zu alkalischen Hydroxiden in Wasser unlöslich ist:
2 EU + 6 h2O → 2 EU (OH)3 + 3 h2
Auch wenn es in einem leichteren oxidiert in den USA brennt2ENTWEDER3 Und entließ eine rötliche Flamme, die an die von Lithium erinnert:
4 EU + 3 o2 → 2 EU2ENTWEDER3
Das Europium kann viele Verbindungen mit dem Oxidationszustand von +2 bilden, weil es seine Orbitale hat F halb voll (4f7), was seinem Atom eine ungewöhnliche elektronische Stabilität verleiht.
Das EU -Kation2+ präsentiert ein chemisches Verhalten, das dem von BA ähnelt2+, Aber im Gegensatz zu letzteren wirkt es als mäßig starkes Reduktionsmittel und oxidiert die USA3+.
Erhalten
Rohmaterial
Das Europium ist in Seltenerd Mineralien wie Bastnasita und Monazit vorhanden. Da es jedoch in Bezug. Deshalb ist Ihr Erhalten sehr teuer.
Prozesse
Die EU -Ionen3+ Sie sind Teil vieler Rost- und Seltenerdphosphate. Der erste Schritt besteht daher darin, sie von den anderen vorhandenen Metallen zu trennen. Dazu werden Mineralien verarbeitet, insbesondere der Bastnasiten; Sie werden berührt, löst sich in starken Säuren oder Basen auf, und fraktionierte Niederschläge werden unter Verwendung verschiedener Reagenzien ausgesetzt. Ebenso wird die Ionenaustauschchromatographie verwendet, um die USA zu trennen3+.
Wenn das Mineral verarbeitet wird, wird ein Konzentrat von EU -Ionen erhalten3+, das kann mit metallischem Zink oder einem Amalgam davon reduziert werden, damit sie in die USA reduziert werden2+. Dann die USA2+ Coprecipita auf Carbonat oder Bariumsulfat.
Kann Ihnen dienen: katalytische HydrierungDieser Niederschlag wird gehalten und erfährt eine Trennung, um das EU -Oxid zu erhalten2ENTWEDER3, die mit Lantano in einem Schmelztiegel von Tantalio reduziert wird, um endlich das metallische Europium zu destillieren und zu kondensieren.
Eine andere Methode, um das Europium zu erhalten3 und NaCl oder Cacl2 geschmolzen. Somit tritt Chlorgas an der Anode auf, während der metallische Europio in der Kathode gebildet wird.
Verwendet/Anwendungen
 Die in diesem Euro -Ticket unter einer UV -Lampe beobachtete rötliche Lumineszenz ist auf eine Europiumverbindung zurückzuführen. Quelle: Repro von h. Grobe/CC BY (https: // creativecommons.Org/lizenzen/bis/3.0)
Die in diesem Euro -Ticket unter einer UV -Lampe beobachtete rötliche Lumineszenz ist auf eine Europiumverbindung zurückzuführen. Quelle: Repro von h. Grobe/CC BY (https: // creativecommons.Org/lizenzen/bis/3.0) Das Europium in seiner metallischen Form fehlt Routine verwendet. Seine Verbindungen sind jedoch eine andere Geschichte, insbesondere sein EU -Oxid2ENTWEDER3, deren Phosphoreszenz von einer unverzichtbaren Komponente der Bildschirme auf den Geräten, Monitoren und Fernsehern hergestellt wurde. Dies liegt daran, dass es sich um einen roten Phosphor handelt, der ein charakteristisches rotes Licht emittiert.
Die rötliche Phosphoreszenz des Europio (III) wird auch verwendet, um zu verhindern.
Andererseits wird ein weißes Licht erhalten, wenn sie mit Euro (II) -Verbindungen gemischt sind, die bläulich sind, sehr wiederkehrend im Glas von Fluoreszenzlampen.
Das Europium wird in kleinen Mengen zu Strontium -Aluminat zugesetzt, um Phosphors verschiedener Farben herzustellen, die sich durch eine langfristige Phosphoreszenz auszeichnen.
Verweise
- Shiver & Atkins. (2008). Anorganische Chemie. (vierte Edition). Mc Graw Hill.
- Nationales Zentrum für Biotechnologie Information. (2020). Europium. Pubchem -Elementzusammenfassung. Erholt von: Pubchem.NCBI.NLM.NIH.Regierung
- Wikipedia. (2020). Europium. Abgerufen von: in.Wikipedia.Org
- Die Herausgeber von Enyclopaedia Britannica. (2020). Europium. Erholt von: Britannica.com
- R. J. Ehemann et al. (27. August 2012). Europium-IV: ein in Verbindunggläubiger. Erholt aus: Zeitschriften.APS.Org
- David. Skowron. (26. November 2017). Wofür wird Europium verwendet?? - Gemeinsame und historische Verwendungen. Lernen. Erholt von: Studium.com
- DR. Doug Stewart. (2020). Europium -Element -Fakten. Erholt von: Chemicoolool.com
- « Monotheismus Herkunft, Merkmale und Religionen
- Kulturunterschiede Konzept und Beispiele zwischen den Ländern »

