Rutherford Experiment History, Beschreibung und Schlussfolgerungen
- 3469
- 429
- Tizian Liebich
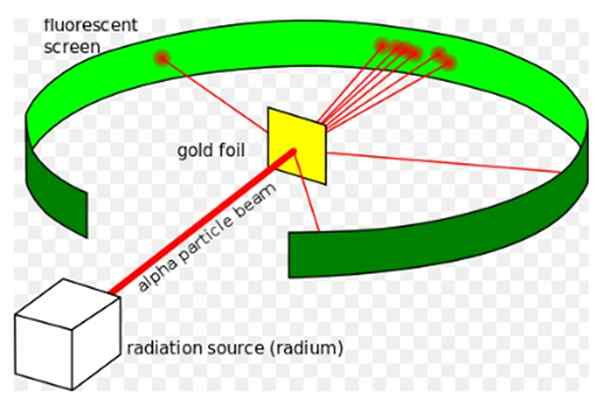
Er Rutherford Experiment, zwischen 1908 und 1913 durchgeführt, bestand es darin, ein dünnes Goldblatt von 0 zu bombardieren.0004 mm dick, mit Alpha -Partikeln und analysieren Sie das Dispersionsmuster, das diese Partikel auf einem fluoreszierenden Bildschirm hinterlassen haben.
Tatsächlich führte Rutherford zahlreiche Experimente durch, um die Details immer mehr zu verfeinern. Nach sorgfältiger Analyse der Ergebnisse wurden zwei sehr wichtige Schlussfolgerungen enthüllt:
-Die positive Belastung des Atoms konzentriert sich in einer Region genannt Kern.
-Dieser Atomkern ist im Vergleich zur Größe des Atoms unglaublich klein.
 Abbildung 1. Rutherfords Experiment. Quelle: Wikimedia Commons. Kurzon [CC BY-SA 3.0 (https: // creativecommons.Org/lizenzen/by-sa/3.0)]]
Abbildung 1. Rutherfords Experiment. Quelle: Wikimedia Commons. Kurzon [CC BY-SA 3.0 (https: // creativecommons.Org/lizenzen/by-sa/3.0)]] Ernest Rutherford (1871-1937) war ein in Neuseeland geborener Physiker, dessen Interessensfeld Radioaktivität und Natur der Materie war. Die Radioaktivität war ein kürzliches Phänomen, als Rutherford mit seinen Experimenten begann. Henri Becherel 1896 wurde von Henri entdeckt.
1907 zog Rutherford an die Universität von Manchester in England, um die Struktur des Atoms zu untersuchen, wobei diese Alpha -Partikel als Sonden verwendet wurden, um das Innere einer solchen winzigen Struktur zu prüfen. Physiker Hans Geiger und Ernest Marsden begleiteten ihn in der Aufgabe.
Sie hatten die Hoffnung zu sehen.
Die meisten Alpha -Partikel überquerten jedoch die Goldblech, die nur eine kleine Abweichung litt.
Diese Tatsache stimmte jedoch insgesamt überein mit Thomsons Atommodell zur Überraschung der Forscher, einem kleinen Prozentsatz der Alpha -Partikel erlebten eine ziemlich bemerkenswerte Abweichung.

Und ein noch kleinerer Prozentsatz der Partikel kehrte zurück und sprang vollständig nach hinten ab. Warum waren diese unerwarteten Ergebnisse?
[TOC]
Beschreibung und Schlussfolgerungen des Experiments
Tatsächlich sind die Alpha -Partikel, die Rutherford als Sonde verwendete. Heute ist bekannt, dass Alpha -Partikel aus zwei Protonen und zwei Neutronen bestehen.
Alfa und Beta -Partikel wurden von Rutherford als zwei verschiedene Arten von Strahlung aus Uran identifiziert. Alpha -Partikel, viel massiver als das Elektron, haben eine positive elektrische Ladung, während Beta -Partikel Elektronen oder Positronen sein können.
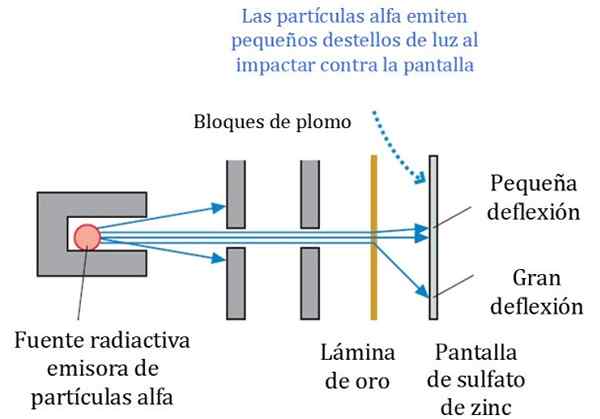 Figur 2. Detailliertes Schema des Experiments Rutherford, Geiger und Marsden. Quelle: r. Ritter. Physik für Wissenschaftler und Ingenieurwesen: Ein Strategieansatz. Pearson.
Figur 2. Detailliertes Schema des Experiments Rutherford, Geiger und Marsden. Quelle: r. Ritter. Physik für Wissenschaftler und Ingenieurwesen: Ein Strategieansatz. Pearson. Abbildung 2 zeigt ein vereinfachtes Schema des Experiments. Der Alpha -Partikelstrahl stammt aus einer radioaktiven Quelle. Geiger und Marsden verwendeten Radongas als Emitter.
Bleiblöcke wurden verwendet, um die Strahlung auf das Goldblatt zu lenken und zu verhindern, dass sie direkt am Fluoreszenzbild stehen,. Blei ist ein Material, das Strahlung absorbiert.
Kann Ihnen dienen: Centrioles: Funktionen und EigenschaftenDann wurde der gerichtete Strahl auf ein dünnes Goldblatt beeinflusst und die meisten Partikel folgen ihrem Weg zum fluoreszierenden Zinksulfatbildschirm, wo sie einen kleinen leichten Fußabdruck hinterließen. Geiger war dafür verantwortlich, sie einzeln zu zählen, obwohl sie dann ein Gerät entworfen haben, das es tat.
Die Tatsache, dass einige Partikel eine kleine Ablenkung erlebten, überraschte Rutherford, Geiger und Marsden nicht. Schließlich gibt es im Atom positive und negative Ladungen, die die Stärke der Alpha -Partikel ausüben, aber da das Atom neutral ist, was sie bereits wussten, sollten die Abweichungen klein sein.
Die Überraschung des Experiments ist, dass ein paar positive Partikel fast direkt abprallten.
Schlussfolgerungen
Etwa 1 in 8000 Alpha -Partikeln erlebte eine Ablenkung bei Winkeln von mehr als 90 °. Wenige, aber genug, um einige Dinge in Frage zu stellen.
Das Atommodell in Boga war das von Thomsons Pudin, dem ehemaligen Rutherford -Professor am Cavendish Laboratory, aber er fragte sich, ob die Idee eines Atoms ohne Kern und mit den als Rosinen eingebetteten Elektronen richtig war.
Weil sich herausstellt, dass diese große Ablenkung der Alpha -Partikel und die Tatsache, dass einige zurückkehren können. Rutherford ging davon aus.
Wenn sich einige der Alpha -Partikel direkt dem Kern nähern und die elektrische Kraft mit dem umgekehrten Quadrat der Entfernung variiert, spüren sie eine Abstoßung, die ihnen die Dispersion eines großen Winkels oder der Abweichung nach hinten veranlasst.
Um sicherzustellen, dass Geiger und Marsden Bombenbombenblätter verschiedener Metalle erlebten, nicht nur Gold, obwohl dieses Metall für ihre Formbarkeit am besten geeignet war, um sehr feine Blätter zu schaffen.
Als Rutherford ähnliche Ergebnisse erzielte, überzeugte er, dass sich die positive Belastung im Atom im Kern befinden und nicht in seinem gesamten Volumen verteilt wurde, wie Thomson in seinem Modell postulierte.
Andererseits, wie die überwiegende Mehrheit der Alpha -Partikel, sollte der Kern im Vergleich zur Atomgröße ohne Abweichung sehr, sehr klein sein. Dieser Kern musste jedoch den größten Teil der Masse des Atoms konzentrieren.
Einflüsse im Atommodell
Die Ergebnisse waren in Rutherford sehr überrascht, der auf einer Konferenz in Cambridge erklärte: „… Es ist so, als würde Sie eine 15 -Zoll -Kanonen -Kugel gegen ein Blatt Seidenpapier schießen, und das Projektil springt direkt zu Ihnen und schlägt Sie".
Kann Ihnen dienen: 10 Funktionen des theoretischen Rahmens einer UntersuchungDa diese Ergebnisse durch Thomsons Atommodell nicht erklärt werden konnten, schlug Rutherford vor, dass das Atom aus einem Kern bestand, sehr klein, sehr massiv und positiv beladen. Die Elektronen beschrieben nach wie vor die Umlaufbahnen um sie herum, welches Solarminiatursystem.
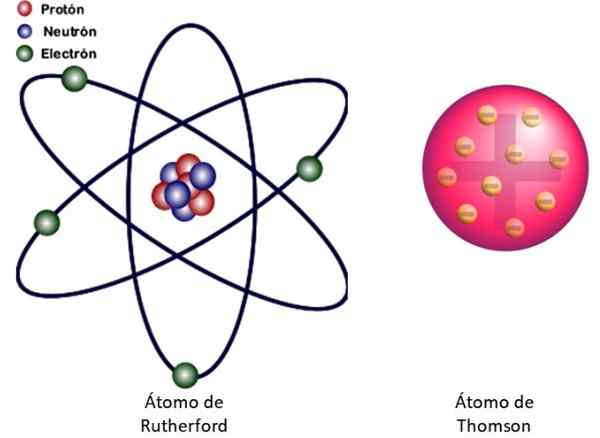 Figur 3. Links das Atommodell von Rutherford und rechts das Buddin -Modell von Thomson's. Quelle: Wikimedia Commons. Linksbild: JCYMC90 [CC BY-SA 4.0 (https: // creativecommons.Org/lizenzen/by-sa/4.0)]]
Figur 3. Links das Atommodell von Rutherford und rechts das Buddin -Modell von Thomson's. Quelle: Wikimedia Commons. Linksbild: JCYMC90 [CC BY-SA 4.0 (https: // creativecommons.Org/lizenzen/by-sa/4.0)]] Dies ist das Kernmodell des in Abbildung 3 gezeigten Atoms links. Da die Elektronen auch sehr, sehr klein sind, stellt sich heraus, dass das Atom fast alles ist .. . leer! Daher kreuzt die meisten Alpha -Partikel das Blatt, ohne nur abweichen.
Und die Analogie zu einem Miniatur -Sonnensystem ist sehr erfolgreich. Der Atomkern spielt die Rolle der Sonne und enthält fast die gesamte Masse plus die positive Belastung. Die Elektronen umgeben sich um sie herum wie die Planeten und tragen die negative Belastung. Der Satz ist elektrisch neutral.
Über die Verteilung der Elektronen im Atom zeigte Rutherfords Experiment nichts. Es könnte angenommen werden, dass Alpha -Partikel eine gewisse Wechselwirkung mit ihnen haben würden, aber die Masse der Elektronen ist zu klein und konnten die Partikel nicht wesentlich ablenken.
Nachteile im Rutherford -Modell
Ein Problem mit diesem Atommodell war genau das Verhalten von Elektronen.
Wenn diese nicht statisch wären, sondern den Atomkern in kreisförmigen oder elliptischen Umlaufbahnen, die durch die elektrische Anziehung gerichtet sind.
Dies liegt daran, dass beschleunigte Elektronen Energie verlieren, und wenn dies geschieht, wäre es der Zusammenbruch des Atoms und der Materie.
Glücklicherweise passiert das nicht das, was passiert. Es gibt eine Art dynamische Stabilität, die den Zusammenbruch vermeidet. Das nächste Atommodell nach Rutherford war das von Bohr, der einige Antworten darauf gab, warum der Atom -Zusammenbruch nicht auftritt.
Das Proton und Neutron
Rutherford führte weiterhin Dispersionsexperimente durch. Zwischen 1917 und 1918 beschlossen er und sein Assistent William Kay zu bombardieren.
Es war wieder überrascht, als Wasserstoffkerne nachgewiesen wurden. Dies ist die Reaktionsgleichung, die erste künstliche nukleare Transmutation hat nie erreicht:
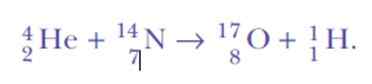 Nun, wenn Alpha -Partikel Heliumkerne sind, wo können Wasserstoffkerne kommen?
Nun, wenn Alpha -Partikel Heliumkerne sind, wo können Wasserstoffkerne kommen?
Die Antwort war: aus demselben Stickstoff. Rutherford hatte der Wasserstoffatomic Nummer 1 zugeordnet, weil es das einfachste Element von allen war: ein positiver Kern und ein negatives Elektron.
Rutherford hatte ein grundlegendes Teilchen gefunden, das er nannte Proton, ein Name, der aus dem griechischen Wort abgeleitet ist Erste. Auf diese Weise ist das Proton ein wesentlicher Bestandteil jedes Atomkerns.
Kann Ihnen dienen: VolumenSpäter, bis 1920, schlug Rutherford vor, dass es ein neutrales Teilchen und eine Masse geben sollte, die dem des Protons sehr ähnlich ist. Er nannte dieses Teilchen Neutron und ist Teil fast aller bekannten Atome. Der Physiker James Chadwick identifizierte es schließlich 1932.
Wie ist ein Skalenmodell des Wasserstoffatoms?
Das Wasserstoffatom ist, wie wir gesagt haben, das einfachste von allen. Es war jedoch nicht einfach, ein Modell für dieses Atom auszuarbeiten.
Aufeinanderfolgende Entdeckungen führten zu Quantenphysik und einer ganzen Theorie, die die Phänomene auf Atomebene beschreibt. Während dieses Prozesses entwickelte sich auch das Atommodell. Aber lassen Sie uns die Frage der Größen ein wenig sehen:
Das Wasserstoffatom hat einen Kern aus einem Proton (positiv) und ein einzelnes Elektron (negativ).
Der Radius des Wasserstoffatoms wurde auf 2 geschätzt.1 x 10-10 m, während das Proton 0 ist.85 x 10 -fünfzehn m oder 0.85 Femtometer. Der Name dieser kleinen Einheit ist auf Enrico Fermi zurückzuführen und wird bei der Arbeit in dieser Skala häufig verwendet.
Nun, der Quotient zwischen dem Radius des Atoms und dem des Kerns liegt in der Größenordnung von 105 M, das heißt das Atom 100.000 -mal größer als der Kern!.
Wir müssen jedoch bedenken Orbital (Ein Orbital ist keine Umlaufbahn) und das Elektron im atomaren Maßstab ist nicht pünktlich.
Wenn das Wasserstoffatom weit verbreitet ist - auf die Größe eines Fußballfeldes, dann wäre der Kern, der aus einem positiven Proton besteht über das Feld und den positiven Kern verteilt und umgibt.
Das Atommodell heute
Dieses "planetarische" Atommodell ist sehr verwurzelt und das Bild, das die meisten Menschen vom Atom haben, da es sehr einfach zu visualisieren ist. Jedoch, es ist nicht Das Modell, das heute im wissenschaftlichen Bereich akzeptiert wird.
Zeitgenössische Atommodelle basieren auf der Quantenmechanik. Sie weist darauf hin, dass das Elektron im Atom kein wenig Punkt mit negativer Belastung ist, der präzise Umlaufbahnen folgt, wie sie beispielsweise von Rutherford vorgestellt wurden.
Im Gegenteil, das Elektron ist verstreut In Gebieten um den positiven Kern genannt atomare Orbitale. Von ihm können wir wissen Wahrscheinlichkeit sich in dem einen oder anderen Zustand zu treffen.
Trotzdem bedeutete das Rutherford -Modell einen großen Fortschritt im Wissen über die innere Struktur des Atoms. Und sie haben den Weg für mehr Forscher übersucht, es weiter zu perfektionieren.
Verweise
- Andriessen, m. 2001. HSC -Kurs. Physik 2. Jacaranda HSC Science.
- Arfken, g. 1984. Universitätsphysik. Akademische Presse.
- Ritter, r. 2017. Physik für Wissenschaftler und Ingenieurwesen: Ein Strategieansatz. Pearson.
- Physik OpenLab. Das Rutherford-Geger-Marsden-Experiment. Erholt von: PhysicicsopenLab.Org.
- Rex, a. 2011. Grundlagen der Physik. Pearson.
- Tyson, t. 2013. Das Rutherford -Streuungsexperiment. Geborgen von: 122.Physik.UCDAVIS.Edu.
- Xaktly. Rutherfords Experimente. Erholt von: xaktly.com.
- Wikipedia. Rutherford Experiment. Erholt von: Es ist.Wikipedia.Org.
- « Autotrophe Ernährungseigenschaften, Stufen, Typen, Beispiele
- Anna Freud Biographie, Theorien, Abwehrmechanismen, Werke »

