Kompressibilitätsfaktor wie berechnet, Beispiele und Übungen
- 1340
- 150
- Ibrahim Steuk
Er Kompressibilitätsfaktor Z, o Der Kompressionsfaktor für Gase ist ein dimensionsloser Wert (ohne Einheiten), der als Korrektur der idealen Gasstatusgleichung eingeführt wird. Auf diese Weise ähnelt das mathematische Modell dem beobachteten Verhalten von Gas mehr.
Im idealen Gas beträgt die Zustandsgleichung, die sich auf die Variablen P (Druck), V (Volumen) und T (Temperatur) bezieht: P.V Ideal = n.R.T mit n = Anzahl der Mol und r = Konstante der idealen Gase. Hinzufügen der Korrektur des Z -Komprimierungsfaktors wird diese Gleichung in:
P.V = z.N.R.T
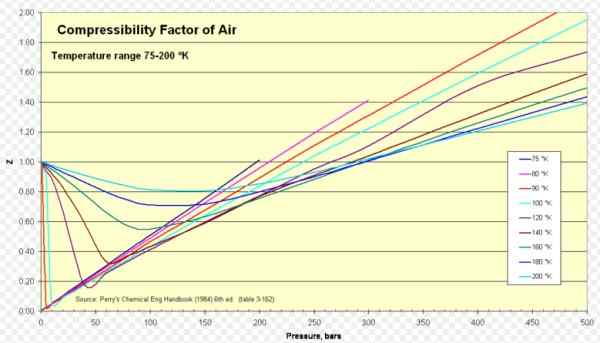
 Abbildung 1. Luftkompressibilitätsfaktor. Quelle: Wikimedia Commons. https: // hochladen.Wikimedia.org/wikipedia/commons/8/84/compressibility_factor_of_air_75-200_k.Png.
Abbildung 1. Luftkompressibilitätsfaktor. Quelle: Wikimedia Commons. https: // hochladen.Wikimedia.org/wikipedia/commons/8/84/compressibility_factor_of_air_75-200_k.Png. [TOC]
So berechnen Sie den Kompressibilitätsfaktor?
Unter Berücksichtigung des Molvolumens ist VCool = V/n, Sie haben das echte Molarenvolumen:
P . Vreal = Z. R. T → z = pv real/Rt
Da der Z -Kompressibilitätsfaktor von den Gasbedingungen abhängt, wird er als Funktion von Druck und Temperatur ausgedrückt:
Z = z (p, t)
Wenn Sie die ersten beiden Gleichungen verglichen, wird darauf hingewiesen, dass das Molvolumen eines realen Gass mit dem des idealen Gass durch die Anzahl der Maulwürfe n gleich 1 beträgt:
Vreal / VIdeal = Z → v real = Z vIdeal
Wenn der Druck die 3 Atmosphären überschreitet.
Dies erkannte in seinen Experimenten den niederländischen Physiker Johannes van der Waals (1837-1923), was ihn dazu veranlasste, ein Modell zu schaffen, das besser an die praktischen Ergebnisse als die Gleichung von idealen Gasen angepasst wurde: die Zustandsgleichung von van der Waals.
Kann Ihnen dienen: Natriumoxalat (Na2C2O4): Struktur, Eigenschaften, Verwendungsmöglichkeiten, RisikenBeispiele
Gemäß der Gleichung P.Vreal= Z.N.Rt, Für ein ideales Gas z = 1. In realen Gasen führt jedoch auch durch Erhöhen des Drucks den Wert von z. Dies ist sinnvoll, da bei größeren Druckgasmolekülen mehr Möglichkeiten zum Kollidieren haben, daher nehmen die Abstoßungskräfte und dadurch das Volumen zu.
Andererseits bewegen sich die Moleküle mit größerer Freiheit und die Abstoßungskräfte nehmen ab. Daher wird ein niedrigeres Volumen erwartet. Was die Temperatur betrifft, nimmt z ab, wenn sie zunimmt.
Wie Van der Waals bemerkte, wird in der Nähe des sogenannten kritischen Punktes das Gasverhalten sehr von einem idealen Gas umgeleitet.
Der kritische Punkt (tC, PC) von einer Substanz sind die Druck- und Temperaturwerte, die ihr Verhalten vor einer Phasenänderung bestimmen:
-TC Es ist die Temperatur, über der das fragliche Gas nicht verflüssigt wird.
-PC Es ist der Mindestdruck, der erforderlich ist, um das Gas bei Temperatur t zu verflüssigenC
Jedes Gas hat jedoch seinen eigenen kritischen Punkt, der die Temperatur und den reduzierten Druck t definiertR Und PR folgendermaßen:
PR = P / pC
VR = V /vC
TR = T /tC
Es wird beobachtet, dass ein mit identisch beschränkter Gas VR Und TR den gleichen Druck ausüben PR. Aus diesem Grund, wenn z je nach grafisch ist PR zum Selben TR, Jeder Punkt in dieser Kurve ist für jedes Gas gleich. Das nennt man Prinzip der entsprechenden Zustände.
Der Kompressibilitätsfaktor bei idealen Gasen, Luft, Wasserstoff und Wasser
Im Folgenden finden Sie eine Kompressibilitätskurve für verschiedene Gase bei verschiedenen reduzierten Temperaturen. Dann einige Beispiele von Z für einige Gase und ein Verfahren, um Z mit der Kurve zu finden.
Kann Ihnen dienen: Wasserstoff: Geschichte, Struktur, Eigenschaften und Verwendung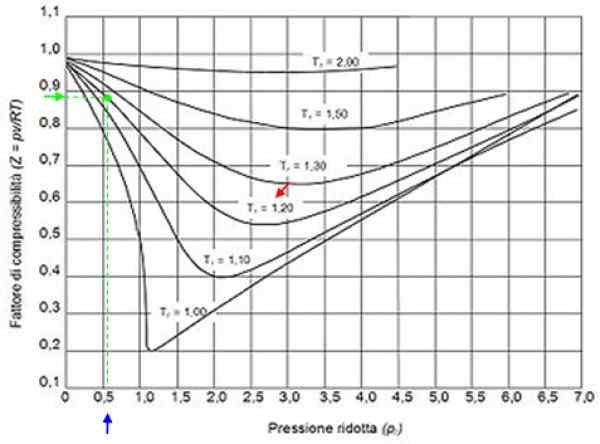 Figur 2. Grafikfaktorgrafiken für Gase nach Reduktionsdruck. Quelle: Wikimedia Commons.
Figur 2. Grafikfaktorgrafiken für Gase nach Reduktionsdruck. Quelle: Wikimedia Commons. Ideale Gase
Die idealen Gase haben z = 1, wie am Anfang erläutert.
Luft
Für Air Z ist ungefähr 1 in einem umfangreichen Bereich von Temperaturen und Drücken (siehe Abbildung 1), wo das ideale Gasmodell sehr gute Ergebnisse liefert.
Wasserstoff
Z> 1 für alle Drucke.
Wasser
Um Z des Wassers zu finden, sind die Werte des kritischen Punktes erforderlich. Der kritische Wasserpunkt ist: pC = 22.09 MPA und tC= 374.14 ° C (647.3 k). Auch hier muss berücksichtigt werden, dass der Z -Kompressibilitätsfaktor von Temperatur und Druck abhängt.
Nehmen wir beispielsweise an, Sie möchten Z aus dem Wasser mit 500 ° C und 12 MPa finden. Dann ist die erste die Berechnung der reduzierten Temperatur, für die die Celsius -Grad an Kelvin übergeben werden müssen: 50 ºC = 773 K:
TR = 773/647.3 = 1.2
PR = 12/22.09 = 0.54
Mit diesen Werten lokalisieren wir die Grafik der Abbildung die Kurve, die T entsprichtR = 1.2, angezeigt mit einem roten Pfeil. Dann schauen wir in der horizontalen Achse den Wert von pR näher an 0.54, blau markiert. Jetzt zeichnen wir eine Vertikale, bis wir die T -Kurve abfangenR = 1.2 und schließlich wird es von diesem Zeitpunkt an die vertikale Achse projiziert, wo wir den ungefähren Wert von z = 0 lesen.89.
Gelöste Übungen
Übung 1
Es gibt eine Gasprobe bei einer Temperatur von 350 K und einen Druck von 12 Atmosphären, wobei ein Molvolumen um 12 % höher ist. Berechnung:
A) Z -Kompressionsfaktor.
b) Molesvolumen von Gas.
Kann Ihnen dienen: Irreversible Reaktion: Merkmale und Beispielec) Geben Sie gemäß den obigen Ergebnissen an.
Daten: r = 0,082 l.atm/mol.K
Lösung für
Zu wissen, dass v real ist 12 % höher als VIdeal :
Vreal = 1.12VIdeal
Z = v real / VIdeal = 1.12
Lösung b
P . Vreal = Z. R. T → vreal = (1.12 x 0.082 x 350 /12) l /mol = 2.14 l/mol.
Lösung c
Die Abstoßungskräfte sind diejenigen, die vorherrschen, da das Volumen der Probe zunahm.
Übung 2
Es gibt 10 Mol Ethan, die in einem Volumen von 4 eingesperrt sind.86 l a 27 ºC. Finden Sie den von Ethane ausgeübten Druck aus:
a) Das ideale Gasmodell
b) die Van der Waals -Gleichung
c) Ermitteln Sie den Kompressionsfaktor aus den vorherigen Ergebnissen.
Daten für Ethan
Van der Waals -Koeffizienten:
A = 5.489 DM6. Geldautomat . Mol-2 und b = 0.06380 DM3. Mol-1.
Kritischer Druck: 49 atm. Kritische Temperatur: 305 K
Lösung für
Die Temperatur wird an Kelvin übergeben: 27 º C = 27 +273 k = 300 K, auch daran, dass 1 Liter = 1 l = 1 dm3.
Dann werden die in der idealen Gasgleichung bereitgestellten Daten ersetzt:
P.V = n.R.T → p = (10 x 0,082 x 300/4.86 l) atm = 50.6 atm
Lösung b
Die Van der Waals -Zustandsgleichung lautet:
Wobei A und B die Koeffizienten sind, die durch die Aussage gegeben wurden. Beim Löschen von P:
Lösung c
Wir berechnen den reduzierten Druck und die reduzierte Temperatur:
PR = 35.2/49 = 0.72
TR = 300 /305 = 0.98 ≈ 1
Bei diesen Werten wird der Wert von Z in der Grafik von Abbildung 2 gesucht und festgestellt, dass Z ungefähr 0 beträgt.7.
Verweise
- Atkins, p. 1999. Physikalische Chemie. Omega -Ausgaben.
- Cengel, und. 2012. Thermodynamik. 7ma Auflage. McGraw Hill.
- Engel, t. 2007. Einführung in die Physikochemie: Thermodynamik. Pearson.
- Levine, ich. 2014. Prinzipien der Physikchemie. 6. Auflage. McGraw Hill.
- Wikipedia. Kompressibilitätsfaktor. Abgerufen von: in.Wikipedia.Org.

