Struktur der Tumornekrosefaktor (TNF), Wirkungsmechanismus, Funktion
- 3982
- 722
- Rieke Scheer
Er Tumornekrosefaktor (TNF), auch als Caquektin bekannt, ist ein natürlich produziertes Protein in phagozytischen oder Makrophagenzellen des menschlichen Körpers und anderer Säugetiertiere. Es ist ein sehr wichtiges Cytoquin, das sowohl an normalen physiologischen Prozessen als auch an der Vielfalt der pathologischen Körperprozesse beteiligt ist.
Seine Entdeckung stammt von vor etwas mehr als 100 Jahren, als W. Coley verwendete rohe bakterielle Extrakte, um Tumoren bei verschiedenen Patienten zu behandeln, und fanden heraus, dass diese Extrakte die Fähigkeit hatten, die Nekrose dieser Tumoren zu induzieren, und gleichzeitig eine systemische Entzündungsreaktion bei Patienten bei Patienten auslösen.
 Tumornekrose-Alpha-Mausfaktor (Quelle: TK Vallery/CC BY-SA (https: // creativeCommons.Org/lizenzen/by-sa/3.0) über Wikimedia Commons)
Tumornekrose-Alpha-Mausfaktor (Quelle: TK Vallery/CC BY-SA (https: // creativeCommons.Org/lizenzen/by-sa/3.0) über Wikimedia Commons) Der wichtigste „proinflammatorische“ Stimulator, der von den von Coley verwendeten bakteriellen Extrakten aktiviert wurde -α)).
Ungefähr 10 Jahre später, im Jahr 1984, wurde das "Tumornekrosefaktor" -Gen isoliert und charakterisiert, und im gleichen Zeitpunkt wurde ein anderes ähnliches Protein in den T -Lymphozyten isoliert und gereinigt, die als "t Alpha t Lymphotoxin" (TLα) bezeichnet wurden, und "T Alpha t Lymphotoxin" (TLα),, und Dies wurde anschließend als TNF-β-Faktor bekannt.
Gegenwärtig wurden zahlreiche Proteine, die dem ursprünglich beschriebenen TNF ähnlich sind, definiert, aus denen die TNF-Proteinfamilie (Tumornekrosefaktor-Typ) und TNF-α, TNF-β-Proteine, CD40 Ligand (CD40L), Ligand FAs (FAS (CD40 Ligand)), bestehen, die Liganden-FAs ((CD40- Fasl) und viele andere.
[TOC]
Struktur
Auf Genebene
Das codierende Gen für das TNF-α-Protein findet sich in Chromosom 6 (Chromosom 17 in Nagetieren) und das, das für das TNF-β-Protein codiert, bevor der vorherige in beiden Fällen (Mensch und Nagetier) vorausgeht (Menschen und Nagetiere). Diese beiden Gene befinden sich in einer einzigen Kopie und haben eine ungefähre Größe von 3 KB.
Angesichts der Tatsache, dass die Sequenz, die der förderenden Region des TNF-α-Gens entspricht Dieser Faktor.
Die Promotorregion des TNF-β-Gens hingegen hat eine Abfolge von Union für ein anderes Protein, das als "High Mobility Group 1" (HMG-1, aus dem Englischen) bekannt ist Hohe Mobilitätsgruppe 1).
Kann Ihnen dienen: Myosin: Eigenschaften, Struktur, Typen und FunktionenAuf Proteinebene
Es wurden zwei Formen des Alfa-Tumornekrosefaktors beschrieben, eine, die mit der Membran (MTNF-α) verbunden ist, und eine andere, die immer löslich ist (STNF-α). Beta-Tumornekrosefaktor existiert dagegen nur in löslicher Form (STNF-β).
Beim Menschen besteht die TNF-α-membranale Form aus einem Polypeptid von etwas mehr als 150 Aminosäureabfällen, die an eine „Leader“ -Sequenz von 76 zusätzlichen Aminosäuren gebunden sind. Es hat ein scheinbares Molekulargewicht von etwa 26 kDa.
Die Translokation dieses Proteins in die Membran tritt während seiner Synthese auf und diese Form wird durch ein Enzym, das als "das konvertierende Enzym von TNF-α" bekannt ist, in die lösliche Form (17 kDa) "umgewandelt", die in der Lage ist -α.
Wirkmechanismus
Proteine, die zur Gruppe der Tumornekrose -Faktorgruppe (TNF) gehören.
Es gibt zwei Arten von Rezeptoren für TNF-Proteine in Plasmamembranen von vielen Körperzellen, mit Ausnahme von Erythrozyten: Typ I-Rezeptoren (TNFR-55) und Typ-II-Rezeptoren (TNFR-75).
Beide Arten von Rezeptoren teilen eine strukturelle Homologie in Bezug auf die extrazelluläre Gewerkschaftsstelle für TNF -Proteine und binden auch mit gleichwertiger Affinität an diese an diese. Sie unterscheiden sich dann in den intrazellulären Signalrouten, die aktivieren.
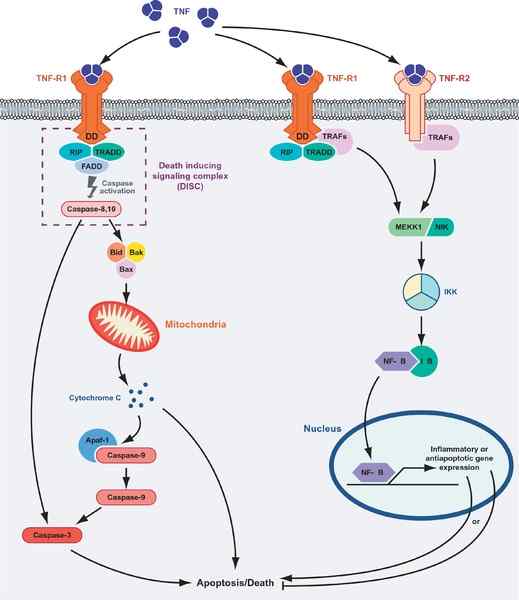 Zelltod oder Überleben durch TNF -Proteine vermittelt. Links von der Grafik wird die apoptotische Route gezeigt und die „Überlebensroute“ (Quelle: Masmudur M. Rahman, Grant McFadden/CC von (https: // CreateRecommons.Org/lizenzen/by/1.0) über Wikimedia Commons)
Zelltod oder Überleben durch TNF -Proteine vermittelt. Links von der Grafik wird die apoptotische Route gezeigt und die „Überlebensroute“ (Quelle: Masmudur M. Rahman, Grant McFadden/CC von (https: // CreateRecommons.Org/lizenzen/by/1.0) über Wikimedia Commons) Die Ligandrezeptor-Wechselwirkung des TNF mit einem seiner Rezeptoren fördert die Vereinigung von drei Rezeptoren zu einem löslichen Trimer des TNF-α (Trimerisierung der Rezeptoren) und die Wechselwirkung löst zelluläre Reaktionen aus, selbst wenn nur 10% der Rezeptoren sind besetzt.
Vereinigung in Rezeptoren vom Typ I
Die Ligand-Rezeptor-Vereinigung mit Typ-I-Rezeptoren dient als „Rekrutierungsplattform“ anderer Signalproteine in den zytosolischen Domänen der Rezeptoren (der interne Teil). Unter diesen Proteinen ist das erste, das das Tradd- oder Proteinprotein mit dem mit dem TNFR-1-Rezeptor assoziierten Todesdomäne (Englisch TNFR-1-assoziiertes Todesdomänenprotein).
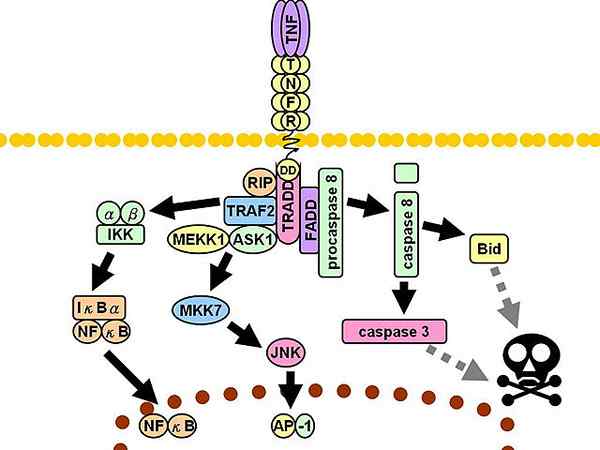 TNFR1 -Signalweg. Diskontinuierliche graue Linien stellen mehrere Schritte dar.
TNFR1 -Signalweg. Diskontinuierliche graue Linien stellen mehrere Schritte dar. Anschließend werden drei zusätzliche Mediatoren rekrutiert: Interaktionsprotein mit Empfänger 1 (RIP1, aus Englisch Receiver-Intering Protein 1), Protein mit dem mit Fas verbundenen Todestodus (FADD, Englisch FAS-assoziiertes Todesdomänenprotein) und Faktor 2, die mit dem TNF -Empfänger verbunden sind (TRAF2, Englisch TNF-Rezeptor-assoziiertes Faktor 2).
Kann Ihnen dienen: Phenylalanin: Eigenschaften, Funktionen, Biosynthese, LebensmittelTyp -II -Rezeptoren
Wenn das TNF an Typ -II -Rezeptoren bindet, führt dies zur direkten Rekrutierung des TRAF2 -Proteins, das wiederum das TRAF1 -Protein rekrutiert. Diese Proteine aktivieren die MAPK -Proteinrouten (aus Englisch Mythogen-aktivierte Proteinkinase), sehr wichtig aus der intrazellulären Signalsicht in Eukaryoten.
Viele der Signalrouten, die nach der Vereinigung von TNF -Faktoren zu ihren Rezeptoren aktiviert werden.
Funktion
Das TNF-α-Protein wird hauptsächlich durch Makrophagen des Immunsystems produziert, während das TNF-β-Protein durch T-Lymphozyten produziert wird. Es wurde jedoch gezeigt, dass andere Körperzellen auch diese Faktoren produzieren, wenn auch in geringerem Maße.
Der Tumornekrosefaktor wurde sehr untersucht, um seine Auswirkungen auf normale physiologische Prozesse sowie bei akuten und chronisch entzündlichen pathologischen Prozessen, bei Autoimmunerkrankungen und bei entzündlichen Prozessen in Bezug auf verschiedene Krebsarten im Zusammenhang.
Diese Proteine sind mit einem schnellen Gewichtsverlust bei Patienten mit akuten bakteriellen Infektionen in Verbindung gebracht, die an Krebs leiden und durch einen septischen "Zusammenstoß" gehen.
Für den Tumornekrosefaktor wurden drei verschiedene biologische Aktivitäten beschrieben:
- Zytotoxizität gegen Tumorzellen
- Unterdrückung der Lipoproteinlipase von Adipozyten (LPL) und
- Reduktion des Ruhepotentials der Myozytenmembran (Muskelzellen).
Die TNF-α-membranale Form fördert die Zytotoxizität und war in den parakrinen Aktivitäten des TNF in bestimmten Geweben beteiligt.
Wenn ein Stimulus als bakterielles Endotoxin wahrgenommen wird, ist diese Form proteolypro aktives TNF in Serum und anderen Körperflüssigkeiten.
Kann Ihnen dienen: Enzym: Betrieb und BeispieleUnter seinen biologischen Funktionen können TNF -Proteine auch zur Aktivierung und Migration von Lymphozyten und Leukozyten beitragen und die Zellproliferation, Differenzierung und Apoptose fördern.
Inhibitoren
Viele Behandlung von Ärzten Rezept TNF-Protein-Inhibitoren für Patienten mit Autoimmunerkrankungen (Anti-TNF-Therapie). Zu diesen Substanzen gehören: Infliximab, Etanercept, Adalimumab, Golimumab und Certolizumab Pegol.
Die häufigste Verwendung der Verwendung ist durch subkutane Injektionen in den Oberschenkel oder Bauch, und sogar eine direkte venöse Infusion wird praktiziert. Trotz dessen, wie viel dieser Substanzen bestimmten Patienten helfen können, haben einige nachteilige Auswirkungen ihrer Verwendung, darunter eine Zunahme des Risikos von Infektionen wie Tuberkulose oder anderen Pilzinfektionen.
"Natürliche" nicht -pharmakologische Inhibitoren
Einige „Schnitt“ -Prüfungen der Proteine der TNF (Typ I und Typ II) haben auch als TNF-Union-Proteine (TNF-BPS, Englisch) bekannt Bindungsproteinefaktor -Nekrose -Tumor) wurden im Urin von Patienten mit Krebs, AIDS oder Sepsis festgestellt.
In einigen Fällen hemmen oder neutralisieren diese Fragmente die Aktivität von TNF-Proteinen, da sie die Ligandenrezeptorwechselwirkung vermeiden.
Andere "natürliche" Inhibitoren von TNF -Proteinen wurden in einigen Pflanzenprodukten nachgewiesen, die aus Kurkuma und Granate stammen, obwohl in dieser Hinsicht noch Studien durchgeführt werden.
Verweise
- Baud, v., & Karin, m. (2001). Signaltransduktion durch Tumornekrosefaktor und seine Verwandten. Trends in der Zellbiologie, 11 (9), 372-377.
- Chu, w. M. (2013). Faktor -Nekrose -Tumor. Cancer Lotters, 328 (2), 222-225.
- Kalliolias, g. D., & Ivkiv, l. B. (2016). TNF -Biologie, pathogene Mechanismen und aufkommende therapeutische Strategien. Nature Reviews Rheumatology, 12 (1), 49.
- Lis, k., Kuzawińska, oder., & Bałkowiec -iskra und. (2014). Nekrose-Tumor-Inhibitoren-Staaten-Faktor des Wissens. Archiv der Medizin: AMS, 10 (6), 1175.
- Tracey, MD, K. J., & Cerami, ph. Gibt. (1994). Nekrose -Tumorfaktor: ein pleiototropes Zytokin und ein therapeutisches Ziel. Jährliche Überprüfung der Medizin, 45 (1), 491-503.
- Wu, h., & Hymowitz, s. G. (2010). Struktur und Funktion des Tumornekrosefaktors (TNF) an der Zelloberfläche. Im Handbuch der Zellsignalisierung (pp. 265-275). Akademische Presse.
- « Kaliumphosphat (K3PO4) -Struktur, Eigenschaften, verwendet
- Was ist die Theorie der Geschichte oder der Historiologie? »

