Faktoren, die die Löslichkeit beeinflussen
- 3282
- 696
- René Riediger
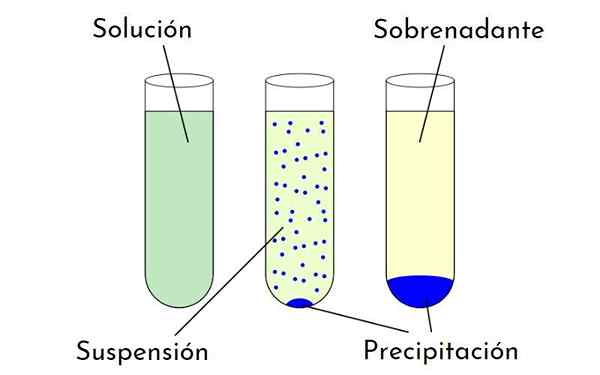
 Diagramm, das die Unterschiede zwischen einer Lösung, einer Federung und einem Niederschlag zeigt, der einen Niederschlag und einen Überstand bildet. Quelle: Zabmilenko: Orninolzofari: VectorMrmw: Optimiert, Multilang, Wikimedia Commons
Diagramm, das die Unterschiede zwischen einer Lösung, einer Federung und einem Niederschlag zeigt, der einen Niederschlag und einen Überstand bildet. Quelle: Zabmilenko: Orninolzofari: VectorMrmw: Optimiert, Multilang, Wikimedia Commons Was sind die Faktoren, die die Löslichkeit beeinflussen??
Hauptsächlich Faktoren, die die Löslichkeit beeinflussen Sie sind Polarität, die Auswirkung des gemeinsamen Ionen, der Temperatur, des Drucks, des gelösten Natures und der mechanischen Faktoren. Löslichkeit ist die Fähigkeit einer festen, flüssigen oder gasförmigen Chemikalie (als gelöster gelöster), sich in Lösungsmittel (normalerweise eine Flüssigkeit) aufzulösen und eine Lösung zu bilden.
Die Löslichkeit einer Substanz hängt grundsätzlich vom verwendeten Lösungsmittel sowie von Temperatur und Druck ab. Die Löslichkeit einer Substanz in einem bestimmten Lösungsmittel wird durch die Konzentration der gesättigten Lösung gemessen.
Eine Lösung wird als gesättigt angesehen, wenn die Zugabe von zusätzlichem gelösten Stoff die Konzentration der Lösung nicht mehr erhöht.
Der Lösungsgrad variiert stark von den Substanzen, von unendlich löslich (vollständig mischbar) wie Ethanol in Wasser bis zu wenig löslich, als Silberchlorid in Wasser. Der Begriff "unlöslich" gilt häufig für kleine lösliche Verbindungen.
Bestimmte Substanzen sind in allen Anteilen mit einem bestimmten Lösungsmittel wie Ethanol im Wasser löslich. Diese Eigenschaft ist bekannt als Mischbarkeit.
Unter verschiedenen Bedingungen kann die Gleichgewichtslöslichkeit überwunden werden, um eine Lösung zu ergeben, die als übersättigter bezeichnet wird.
Hauptfaktoren, die die Löslichkeit beeinflussen
1. Polarität
In den meisten Fällen lösen sich gelöste Stoffe in Lösungsmitteln auf, die eine ähnliche Polarität haben. Chemiker verwenden einen beliebten Aphorismus, um dieses Merkmal von gelösten Stoff und Lösungsmitteln zu beschreiben: "Ähnliche löst sich ähnlich auf".
Nichtpolare gelöste Stoffe lösten sich nicht in polaren Lösungsmitteln auf und umgekehrt.
2. Gemeinsamer Ioneneffekt
Der gemeinsame Ioneneffekt ist ein Begriff, der die Abnahme der Löslichkeit einer ionischen Verbindung beschreibt, wenn ein Salz ein Ion enthält, das bereits im chemischen Gleichgewicht vorhanden ist.
Dieser Effekt wird am besten durch Le Châteliers Prinzip erklärt. Stellen Sie sich vor, die Verbindung Calciumsulfat leicht löslich, Fall4, Es wird dem Wasser hinzugefügt. Die Netto -Ionengleichung für den resultierenden chemischen Gleichgewicht lautet wie folgt:
Case4 (s) ⇌ca2+(aq)+SO42– (aq)
Calciumsulfat ist leicht löslich. Im Gleichgewicht existieren das meiste Kalzium und Sulfat fest aus Calciumsulfat.
Es kann Ihnen dienen: iarhydsäure (HI): Struktur, Eigenschaften und VerwendungAngenommen, die ionische Verbindung löslicher Kupfersulfat (CUO4) Es wurde der Lösung hinzugefügt. Kupfersulfat ist löslich. Daher ist sein einziger wichtiger Effekt auf die Netto -ionische Gleichung die Zugabe von mehr Sulfationen (also42-).
CUSO4 (s) ⇌cu2+(aq)+SO42– (aq)
Die dissoziierten Sulfationen von Kupfersulfat sind bereits in der Mischung aus der leichten Dissoziation von Calciumsulfat vorhanden (gemeinsam a).
Daher betont diese Zugabe von Sulfationen das zuvor etablierte Gleichgewicht.
Das Prinzip von Le Catelier schreibt vor, dass die zusätzliche Anstrengung auf dieser Seite des Gleichgewichtsprodukts zur Veränderung des Gleichgewichts zur Seite der Reaktanten führt, um diese neue Spannung zu lindern.
Aufgrund der Änderung der reagierenden Seite wird die lösliche Calciumsulfatlöslichkeit weiter verringert.
3. Temperatur
Die Temperatur wirkt sich direkt auf die Löslichkeit aus. Für die meisten ionischen Feststoffe erhöht die Temperaturanstieg die Geschwindigkeit, mit der die Lösung hergestellt werden kann.
Wenn sich die Temperatur zunimmt. Dies führt zu einer Erhöhung der Geschwindigkeit, bei der eine Lösung auftritt.
Die Temperatur kann auch die Menge an gelösten Stoff erhöhen, die in einem Lösungsmittel gelöst werden kann. Im Allgemeinen löst sich mehr gelöste Partikel auf, wenn die Temperatur zunimmt.
Wenn beispielsweise Zucker zu Wasser zugesetzt wird, ist es eine einfache Methode, eine Lösung zu erstellen. Wenn diese Lösung erhitzt wird und der Zucker noch zugesetzt wird, wird festgestellt, dass große Mengen Zucker zugesetzt werden können, wenn die Temperatur weiter zunimmt.
Der Grund dafür ist, dass mit zunehmende Temperatur intermolekulare Kräfte leichter gebrochen werden können, sodass mehr gelöste Partikel von Lösungsmittelpartikeln angezogen werden können.
Kann Ihnen dienen: Magnesium: Geschichte, Struktur, Eigenschaften, Reaktionen, verwendetEs gibt jedoch andere Beispiele, bei denen die Temperaturerhöhung nur sehr geringe Auswirkungen auf die Menge an gelösten Stoff hat, die gelöst werden können.
Tischsalz ist ein gutes Beispiel: Sie können fast die gleiche Menge Tischsalz in Eiswasser auflösen, die Sie im kochenden Wasser können.
Bei allen Gasen nimmt die Löslichkeit mit zunehmender Temperatur ab. Die kinetische molekulare Theorie kann verwendet werden, um dieses Phänomen zu erklären.
Wenn die Temperatur zunimmt, bewegen sich Gasmoleküle schneller und können der Flüssigkeit entkommen. Gaslöslichkeit nimmt also ab.
4. Druck
Der vierte Faktor, der Druck, beeinflusst die Löslichkeit eines Gases in einer Flüssigkeit, aber niemals von einem Feststoff, der sich in einer Flüssigkeit auflöst.
Wenn ein Druck auf ein Gas über der Oberfläche eines Lösungsmittels ausgeübt wird, bewegt sich das Gas zum Lösungsmittel und besetzt einige der Räume zwischen den Lösungsmittelpartikeln.
Ein gutes Beispiel ist kohlensäurehaltiges Soda. Der Druck wird zur Kraft -Ko₂ -Moleküle im Soda ausgeübt. Das Gegenteil ist auch wahr. Wenn der Gasdruck abnimmt, nimmt die Löslichkeit dieses Gases ebenfalls ab.
Wenn sich ein Getränk mit Soda -Getränk öffnet, wird der Druck in der Soda gesenkt, sodass das Gas sofort aus der Lösung herauskommt.
Kohlendioxid, die in der Soda gespeichert sind. Wenn eine offene Dose Soda für einen bestimmten Zeitraum übrig bleibt, können wir feststellen, dass das Getränk aufgrund des Kohlendioxidverlusts flach wird.
Dieser Gasdruckfaktor wird im Henryschen Gesetz ausgedrückt. Das Henrysche Gesetz stellt fest, dass bei einer bestimmten Temperatur die Löslichkeit eines Gases in einer Flüssigkeit proportional zum Teildruck des Gases auf der Flüssigkeit ist.
Kann Ihnen dienen: Normale Lösungen: Konzept, Vorbereitung, BeispieleEin Beispiel für Henrys Gesetz wird beim Tauchen erzeugt. Wenn sich eine Person in tiefes Wasser eintaucht, nimmt der Druck zu und mehr Gase löst sich im Blut auf.
Während der Taucher aus tiefem Wasser steigt, muss er mit sehr langsamer Geschwindigkeit an die Oberfläche zurückkehren, damit alle gelösten Gase das Blut sehr langsam lassen können.
Wenn eine Person zu schnell aufsteigt, kann ein medizinischer Notfall aufgrund der Gase auftreten, die zu schnell aus dem Blut kommen.
5. Art des gelösten Stoffes
Die Art des gelösten Stoffes und des Lösungsmittels und das Vorhandensein anderer chemischer Verbindungen in der Lösung beeinflusst die Löslichkeit.
Zum Beispiel können Sie eine größere Menge Zucker in Wasser auflösen, was in Wasser herauskommt. In diesem Fall wird gesagt, dass Zucker löslicher ist.
Ethanol im Wasser ist völlig löslich miteinander. In diesem speziellen Fall ist das Lösungsmittel die Verbindung, die sich in größerer Menge befindet.
Die Größe des gelösten Stoffes ist ebenfalls ein wichtiger Faktor. Je größer die Moleküle des gelösten Stoffes sind, desto größer sein Molekulargewicht und seine Größe. Es ist schwieriger für Lösungsmittelmoleküle, größere Moleküle zu umgeben.
Wenn alle oben genannten Faktoren ausgeschlossen sind, ist eine allgemeine Regel festzustellen, dass die größten Partikel im Allgemeinen weniger löslich sind.
Wenn Druck und Temperatur zwischen zwei gelösten gelösten Polarität übereinstimmen, ist die mit kleineren Partikeln normalerweise löslicher.
6. Mechanische Faktoren
Im Gegensatz zur Lösungsgeschwindigkeit, die hauptsächlich von der Temperatur abhängt, hängt die Rekristallisationsgeschwindigkeit von der Konzentration der gelösten Stoffe auf der Oberfläche des kristallinen Netzwerks ab, ein Fall, der bevorzugt wird, wenn eine Lösung bewegungslos ist.
Daher vermeidet die Agitation der Lösung diese Akkumulation und maximiert die Lösung.
Verweise
- Löslichkeit. Von Boundles geborgen.com.
- Faktoren Afffeting Löslichkeit. Von CK12 geborgen.Org.
- Online -Bildung (s.F.). Faktoren Afffeting Löslichkeit. Aus Löslichkeitsofthings abgerufen.com.

