Dispergierte Phase
- 1799
- 61
- Medine Kedzierski
 Quelle: Gabriel Bolívar
Quelle: Gabriel Bolívar Was ist die dispergierte Phase?
Der dispergierte Phase Es ist derjenige, der zu einem geringeren Anteil an einer Dispersion ist und aus sehr kleinen Partikeln zusammengesetzt ist. In der Zwischenzeit wird die häufigste und kontinuierlichste Phase, in der die Partikel liegen. Ein Beispiel ist Wasser mit Zucker, wobei die dispergierte Phase Zucker und das dispergierende Wasser wäre.
Die Dispersionen werden nach der Größe der Partikel klassifiziert, die die dispergierte Phase bilden und drei Arten von Dispersionen unterscheiden können: unhöfliche Dispersionen, kolloidale Lösungen und wahre Lösungen.
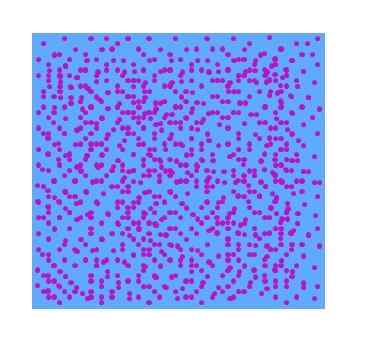
Im überlegenen Bild ist eine hypothetische dispergierte Phase von lila Partikeln in Wasser zu sehen. Infolgedessen zeigt ein Glas mit dieser Dispersion keine Transparenz zu sichtbarem Licht. Das heißt, es wird wie ein lila flüssiger Joghurt aussehen. Die Art der Dispersionen variiert je nach Größe dieser Partikel.
Wenn sie "großartig" sind (10-7 m) Es ist die Rede von unhöflichen Dispersionen und kann durch die Wirkung der Schwerkraft sedimentiert werden; Kolloidale Lösungen, wenn ihre Größen zwischen 10 liegen-9 M und 10-6 M, was sie nur mit Ultramikroskop oder elektronischem Mikroskop sichtbar macht; und wahre Lösungen, wenn ihre Größen weniger als 10 betragen-9 M, in der Lage sein, Membranen zu überqueren.
Wahre Lösungen sind daher alle, die im Volksmund bekannt sind, wie Essig oder zuckerhaltiges Wasser.
Eigenschaften der dispergierten Phase
Die Lösungen bilden einen besonderen Fall von Dispersionen, wobei diese für die Kenntnis der Physierimika der Lebewesen von großem Interesse sind. Die meisten biologischen Substanzen, sowohl intrazellulär als auch extrazellulär, befinden sich in Form von Aufrufen von Dispersionen.
Brownsche Bewegung und Tyndall -Effekt
Die Teilchen der dispergierten Phase kolloidaler Lösungen haben eine geringe Größe, die ihre Sedimentation behindert. Darüber hinaus bewegen sich Partikel ständig in zufälliger Bewegung, die miteinander kollidieren, was auch die Sedimentation erschwert. Diese Art von Bewegung ist als Brownian bekannt.
Kann Ihnen dienen: violettes GlasAufgrund der relativ großen Größe der dispergierten Phasenpartikel haben kolloidale Lösungen ein trübes oder sogar undurchsichtiges Aussehen. Dies liegt daran, dass das Licht verteilt ist, wenn das Kolloid kreuzt.
Heterogenität
Kolloidale Systeme sind nicht homogene Systeme, da die dispergierte Phase aus Partikeln mit einem Durchmesser zwischen 10 besteht-9 M und 10-6 M. Während die Lösungspartikel von einer kleineren Größe sind, normalerweise weniger als 10-9 M.
Die Partikel der dispergierten Phase kolloidaler Lösungen können Filterpapier und Tonfilter überqueren. Aber sie können Dialysemembranen wie Cellophan, Kapillarendothel und Kolodion nicht überschreiten.
In einigen Fällen sind die Partikel, die die dispergierte Phase bilden. Wenn sie sich in wässriger Phase befinden, falten sich die Proteine und lassen den hydrophilen Teil eine größere Wechselwirkung mit Wasser, durch die Ionen-Dipolo-Kräfte oder mit der Bildung von Wasserstoffbrücken.
Proteine bilden ein retikuläres System in den Zellen, das einen Teil des Dispergierers nehmen kann. Darüber hinaus dient die Oberfläche der Proteine zu kleinen Molekülen, die eine oberflächliche elektrische Ladung verleihen, die die Wechselwirkung zwischen Proteinmolekülen begrenzt und sie daran hindert.
Stabilität
Kolloide werden gemäß der Anziehungskraft zwischen der dispergierten Phase und der Dispersionsphase klassifiziert. Wenn die Dispersionsphase flüssig ist, werden kolloidale Systeme als Sonnen klassifiziert. Diese werden in Delphilos und Liophoben unterteilt.
Es kann Ihnen dienen: Kaliumchlorat (KCLO3)Liophile Kolloide können echte Lösungen bilden und sind thermodynamisch stabil. Andererseits können die LioPhobes -Kolloide zwei Phasen bilden, da sie instabil sind, obwohl sie aus der kinetischen Sicht stabil sind. Dies ermöglicht es ihnen, lange Zeit in einem verteilten Zustand zu bleiben.
Beispiele für dispergierte Phasen
Sowohl die Dispersionsphase als auch die dispergierte Phase können in den drei physikalischen Zuständen der Materie auftreten, dh fest, flüssig oder gasförmig.
Normalerweise befindet sich die kontinuierliche oder dispergierende Phase in einem flüssigen Zustand, aber Kolloiden, deren Komponenten in anderen Aggregationszuständen der Materie zu finden sind.
Die Möglichkeiten der Kombination der Dispersionsphase und der dispergierten Phase in diesen physikalischen Zuständen sind neun.
Jeder wird mit einigen jeweiligen Beispielen erklärt.
- Solide Lösungen: Wenn die Dispersionsphase fest ist.
Dies sind Beispiele für diese Wechselwirkungen: viele Stahllegierungen mit anderen Metallen, einigen farbenfrohen Edelsteinen, verstärktem Gummi, Porzellan und pigmentierten Kunststoffen.
- Solide Emulsionen: Die Festkörperverteilungsphase kann mit einer flüssigen dispergierten Phase kombiniert werden, wobei die sogenannten Festkörperemulsionen bilden. Sie sind Beispiele für diese Interaktionen: Käse, Butter und Gelee.
- Feste Schäume: Die dispergierende Phase als Feststoff kann mit einer dispergierten Phase in einem gasförmigen Zustand kombiniert werden, der die sogenannten Feststoffschaum bildet. Beispiele für diese Wechselwirkungen sind Schwamm, Gummi, Bimsstein und Gummischaum.
- Sohlen und Gele: Die dispergierende Phase im flüssigen Zustand wird mit der dispergierten Phase im Festkörper kombiniert, wobei die Sonnen und Gele bilden. Beispiele für diese Wechselwirkungen sind Magnesia -Milch, Gemälde, Schlamm und Pudin.
Kann Ihnen dienen: Stoßdämpferlösungen- Emulsionen: Die dispergierende Phase im flüssigen Zustand wird auch mit der dispergierten Phase in einem flüssigen Zustand kombiniert und erzeugt die sogenannten Emulsionen. Beispiele für diese Wechselwirkungen sind Milch, Gesichtscreme, Salatverbände und Mayonnaise.
- Schäume: Die dispergierende Phase im flüssigen Zustand wird mit der dispergierten Phase in einem gasförmigen Zustand kombiniert und bildet die Schäume. Beispiele für diese Interaktionen sind die Rasiercreme, die Schlagsahne und der Bierschaum.
- Feste Aerosole: Die dispergierende Phase in einem gasförmigen Zustand wird mit der dispergierten Phase im Festkörper kombiniert und verursacht die sogenannten Festkörper -Aerosole. Beispiele für diese Wechselwirkungen sind Rauch, Viren, korpuskuläre Materialien in der Luft, die Materialien, die von den Abgasrohren von Autos emittiert werden.
- Flüssige Aerosole: Die dispergierende Phase in einem gasförmigen Zustand kann mit der dispergierten Phase im flüssigen Zustand kombiniert werden, was die sogenannten Flüssigsprays ausmacht. Beispiele für diese Wechselwirkungen sind Nebel, Nebel und Tau.
- Wahre Lösungen: Die dispergierende Phase in einem gasförmigen Zustand kann mit der gasförmigen Phase im gasförmigen Zustand kombiniert werden, wobei die gasförmigen Gemische bilden, die echte Lösungen und nicht kolloidale Systeme sind. Beispiele für diese Wechselwirkungen sind die Luft und das Beleuchtungsgas.
Verweise
- Whitten, Davis, Peck & Stanley. Chemie (8.ª ed.). Cengage Lernen.
- TOPPR (s.F.). Klassifizierung von Kolloiden. Erholt von: topppr.com
- Jiménez Vargas, J und Macarulla. J. M. (1984). Physiologische Physikochemie, sechste Ausgabe. Inter -American Editorial.
- Madhusha. Unterschied zwischen Dispersephase und Dispersionsmedum. Erholt von: Pediaa.com

