Phenylalanineigenschaften, Funktionen, Biosynthese, Lebensmittel
- 3782
- 558
- Rieke Scheer
Der Phenylalanin (Phe, f) ist eine der 9 essentiellen Aminosäuren, das heißt, sie wird nicht endogen vom menschlichen Körper synthetisiert. In seiner Seitenkette hat diese Aminosäure eine nichtpolare aromatische Verbindung, die sie charakterisiert.
Das Phenylalanin oder β-Phenyl-α-Amino-Propionsäure wurde erstmals 1879 von Wissenschaftlern J identifiziert. H. Schulze und m. Barbieri aus einer Pflanze aus der Familie Fabaceae als bekannt als als Lupinus luteus oder "Yellow Altramuz".
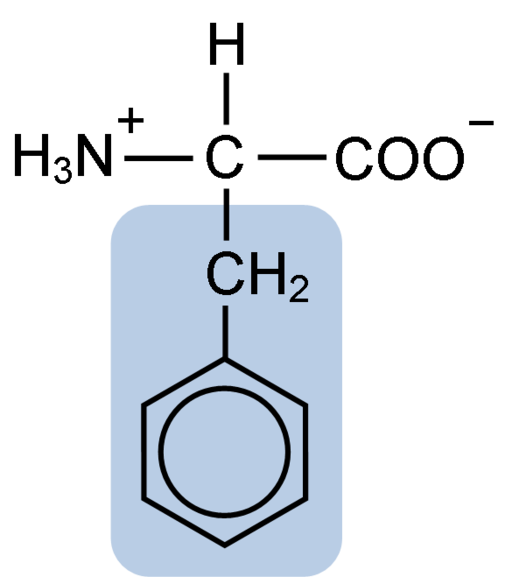
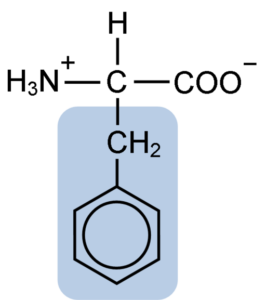 Chemische Struktur des Aminosäure-Phenylalanin (Quelle: Clavecin [CC BY-SA 4.0 (https: // creativecommons.Org/lizenzen/by-sa/4.0)] über Wikimedia Commons)
Chemische Struktur des Aminosäure-Phenylalanin (Quelle: Clavecin [CC BY-SA 4.0 (https: // creativecommons.Org/lizenzen/by-sa/4.0)] über Wikimedia Commons) Das Dipéptide L-fenylalanin-l-Aspartil ist als Aspartam oder "Nutrasweet" bekannt.
In Früchten mit beheizten Eigenschaften führt die Umwandlung von L-Phenylalanin in phenolischen Estern wie Eugenol und seinen metilischen Derivaten zu dem süßen Blumgeruch oder dem typischen Honig von Bananen und Bananen, wenn sie reift.
Abhängig von der Form kann Phenylalanin unterschiedliche Geschmacksrichtungen haben. Zum Beispiel hat die L-Fenylalanin-Form ein süßes Aroma und ein süßes Aroma, während D-Fenylalanin leicht bitter ist und normalerweise Tood.
Da es einen starken hydrophoben Charakter hat, ist Phenylalanin einer der Hauptbestandteile vieler Harze in der Natur, wie z. B. Polystyrol. Diese Harze bilden, wenn sie mit Wassermolekülen in Kontakt kommen, eine Schutz- oder Abdeckungsstruktur, die als "Clatrato" bezeichnet wird.
Die Gene, die für den Biosyntheseweg von Phenylalanin kodieren.
[TOC]
Eigenschaften und Struktur
Phenylalanin teilt mit allen Aminosäuren die Carboxylgruppe (-coh), die Amino-Gruppe (-nh2) und das Wasserstoffatom (-H), das an ein zentrales Kohlenstoffatom gebunden ist, das als Kohlenstoff α bekannt ist. Außerdem hat es natürlich eine Seitenkette oder eine charakteristische R -Gruppe.
Phenylalanin ist eine der drei Aminosäuren, die aromatische oder Benzolringe als Substituenten in seitlichen Ketten haben. Diese Verbindungen sind nicht polar und daher stark hydrophobisch.
Die fragliche Aminosäure ist besonders hydrophober, da im Gegensatz zu Tyrosin und Tryptophan (die beiden anderen Aminosäuren mit aromatischen Ringen) keine Amino- oder Hydroxylgruppen haben, die mit ihrem Benzolring vereint sind.
Die aromatische, benzoische oder sandylalanin -Gruppe von Phenylalanin hat die typische Benzolstruktur: Der zyklische Ring ist durch 6 Kohlenstoffatome strukturiert.
Im Gegensatz zu Tyrosin und Tryptophan, die eine positive bzw. negative Belastung erwerben können, behält Phenylalanin seine neutrale Belastung bei.
Einstufung
Aminosäuren werden nach den Eigenschaften, die ihre Seitenketten oder R -Gruppen haben, in verschiedene Gruppen eingeteilt.
Wie bereits erwähnt, wird Phenylalanin zusammen mit Tyrosin und Tryptophan innerhalb der Gruppe aromatischer Aminosäuren klassifiziert. Alle diese Verbindungen haben aromatische Ringe in ihrer Struktur. Tyrosin und Tryptophan haben jedoch ionisierbare Gruppen in den Substituenten ihrer R -Gruppen.
Kann Ihnen dienen: Allopatrische Speziation: Konzept, Prozess und BeispieleDie Proteinlichtabsorptionseigenschaften bei einer Wellenlänge von 280 nm sind auf das Vorhandensein der in der Phenylalaningruppe klassifizierten Aminosäuren zurückzuführen, da sie leicht ultraviolettes Licht durch ihre aromatischen Ringe absorbieren.
Es wurde jedoch gezeigt, dass Phenylalanin in viel weniger proportional absorbiert als Tyrosin und Tryptophan.
Stereochemie
Alle Aminosäuren haben einen zentralen quiralen Kohlenstoff, der vier United Atome oder Gruppen hat, und wie bereits gesagt, wird dieses Atom als Kohlenstoff α identifiziert. Basierend auf diesem Kohlenstoff können mindestens zwei Stereoisomere jeder Aminosäure gefunden werden.
Stereoisomere sind Moleküle mit Spiegelbildern, die die gleiche molekulare Formel aufweisen, die sich jedoch nicht übereinander überlappen, wie zum Beispiel Hände und Füße. Die Verbindungen, die die rechte polarisierte Lichtebene experimentell drehen.
Es ist wichtig zu sagen.
Die L-Phenylalanin-Form wird für den Bau von Zellproteinen metabolisiert und ausgenutzt, während D-Fenylalanin im Blutkreislauf als Schutzmittel gegen reaktive Sauerstoffspezies (ROS) gefunden wurde.
Funktionen
In den 90ern wurde angenommen, dass Phenylalanin nur bei einigen Pflanzenarten war. Heute ist jedoch bekannt, dass es in fast allen hydrophoben Proteinendomänen vorhanden ist. Tatsächlich ist Phenylalanin die Hauptkomponente der aromatischen chemischen Spezies von Proteinen.
In Pflanzen ist Phenylalanin ein wesentlicher Bestandteil aller Proteine; Darüber hinaus ist es einer der Vorläufer von Sekundärmetaboliten wie Phenylpropanoiden (die Teil der Pigmente) von defensiven Molekülen, Flavonoiden, Biopolymeren wie Lignin und Suberin sind.
Phenylalanin ist die Grundstruktur, um viele der Moleküle zu bilden, die die neuronale Homöostase aufrechterhalten, darunter Peptide wie Vasopressin, Melanotropin und Enzephalin. Darüber hinaus ist diese Aminosäure direkt an der Synthese des Adrenocortopic -Hormons (ACTH) beteiligt.
Phenylalanin ist wie ein Groß.
Im Überschuss wird Phenylalanin in Tyrosin und anschließend in Fumarat umgewandelt, einem Vermittler des Krebszyklus.
Biosynthese
Phenylalanin ist eine der wenigen Aminosäuren, die nicht von den meisten Wirbeltierorganismen synthetisiert werden können. Gegenwärtig sind nur Biosynthesewege für diese Aminosäure in prokaryotischen Organismen, in Hefen, in Pflanzen und in einigen Arten von Pilzen bekannt.
Die für die Syntheseroute verantwortlichen Gene sind zwischen Pflanzen und Mikroorganismen sehr erhalten. Daher hat die Biosynthese in fast allen Arten ähnliche Schritte. Sogar einige Enzyme auf dem Weg sind bei einigen Tieren vorhanden, aber diese können es nicht synthetisieren.
Biosynthese von Phenylalanin in Pflanzen
Bei Pflanzenarten wird Phenylalanin durch einen inneren Stoffwechselweg in den als "Predeingasroute" bekannten Chloroplasten synthetisiert. Diese Route ist metabolisch mit der "Shikimato-Route" verwandt, durch den L-Arogenato, einen der in letzteren produzierten Metaboliten.
Kann Ihnen dienen: topoisomerase: Was sind, Eigenschaften, Funktionen, TypenDie inhydratasa istwood -Enzym katalysiert eine Drei -Stufe.
Dieses Enzym katalysiert eine Transaminierung, Dehydration und Dekarn.
Das vorherige Phenylpyruvat im Inneren (das Licht) des Chloroplastes kann durch Reaktion durch das Enzym Aminotransferase propenato, das eine Aminogruppe überträgt und durch die Arogen -Dehydase und wird, wird eine Aminogruppe übertragen und wird, wird durch die Arogen -Dehydase erfasst, die durch die Arogen dehydase und wird, wird, wird durch die Arogen -Dehydase erkannt und wird durch die Arogen -Dehydase erkannt, die durch die Arogen -Dehydase erkannt wird, in Phenylalanin umgewandelt werden. zur Synthese von Phenylalanin.
In einigen Arten von Arten Pseudomonas Alternative Routen wurden zu der des Profenatos beschrieben, die verschiedene Enzyme verwenden, deren Substrate für die Synthese von Phenylalanin jedoch ebenfalls das Raubtier und das Arogenat sind.
Degradierung
Phenylalanin kann auf verschiedene Arten von Lebensmitteln metabolisiert werden. Die größte Menge an Studien konzentriert sich jedoch auf ihr Ziel auf zentralen Nervengewebezellen und Nierengeweben.
Die Leber ist das Hauptorgan für Abbau oder Katabolismus von Phenylalanin. In Hepatozyten gibt es ein Enzym, das als Hydroxylase-Phenylalanin bekannt ist und in der Lage ist, Phenylalanin in Tyrosin oder in der Verbindung L-3,4-Dihydroxyphenylalanin (L-DOPA) umzuwandeln.
Die L-Dopa-Verbindung ist ein Vorläufer von Noradrenalin, Adrenalin und anderen Hormonen und Peptiden mit Aktivität im Nervensystem.
Phenylalanin kann in Gehirnzellen mittels des Hydroxylase-Tyrosinenzyms oxidiert werden, das für die Katalyse der Umwandlung von Phenylalanin in Dopakrom in Gegenwart von L-Ascorbinsäure verantwortlich ist.
Zuvor wurde angenommen, dass die Hydroxylase -Tyrosinhydroxylase nur Tyrosin.
Gegenwärtig ist bekannt, dass hohe Anteile an Tyrosin die enzymatische Aktivität von Hydroxylase -Tyrosin hemmen, aber dasselbe gilt nicht für Phenylalanin.
Lebensmittel, die reich an Phenylalanin sind
Alle proteinreichen Lebensmittel haben einen Phenylalaningehalt zwischen 400 und 700 mg für den Teil der aufgenommenen Lebensmittel. Lebensmittel wie Kabeljauöl, frischer Thunfisch, Hummer, Austern und andere Muscheln enthalten mehr als 1.000 mg pro Teil der aufgenommenen Lebensmittel.
Rinder- und Schweinfleisch haben auch hohe Phenylalaninspiegel. Sie sind jedoch nicht so hoch wie die Konzentrationen bei marinen Tieren. Zum Beispiel haben Speck-, Rind-, Leber-, Hühner- und Milchprodukte zwischen 700 und 900 mg Phenylalanin durch Lebensmittelration.
Nüsse wie Erdnüsse und Nüsse verschiedener Typen sind andere Lebensmittel mit einer guten Menge an Phenylalanin. Getreide wie Sojabohnen, Kichererbsen und andere Hülsenfrüchte können nach Abschnitt zwischen 500 und 700 mg Phenylalanin liefern.
Als alternative Quelle kann Phenylalanin aus Aspartam metabolisiert werden.
Vorteile Ihrer Aufnahme
Phenylalanin wird in allen von uns konsumierten proteinreichen Lebensmitteln gefunden. Der minimale tägliche Verbrauch für Erwachsene und die durchschnittliche Größe beträgt etwa 1000 mg, was für die Proteinsynthese, Hormone wie Dopamin, verschiedene Neurotransmitter usw. erforderlich ist, usw.
Es kann Ihnen dienen: Was ist die natürliche Vielfalt der Erde?Der Verbrauch dieser überschüssigen Aminosäure wird für Menschen mit depressiven Erkrankungen, Gelenkschmerzen und Hautkrankheiten verschrieben, da sein Verbrauch die Synthese von Protein und die Übertragung von Biomolekülen wie Epinephrin, Norpinephrin und Dopamin erhöht.
Einige Studien legen nahe, dass Phenylalanin, das überschüssig verbraucht ist nervöses System.
Gegen Verstopfung formulierte Medikamente haben Kerne, die durch Phenylalanin, Tyrosin und Tryptophan strukturiert sind. Im Allgemeinen enthalten diese Medikamente Gemische dieser drei Aminosäuren in ihren Formen L-y d-.
Mangelerkrankungen
Blutphenylalaninspiegel sind wichtig, um die ordnungsgemäße Funktion des Gehirns aufrechtzuerhalten, da Phenylalanin, Tyrosin und Tryptophan die Substrate für den Zusammenbau verschiedener Neurotransmitter sind.
Einige Störungen beziehen sich eher mit Defiziten im Stoffwechsel dieser Aminosäure, die einen Überschuss davon erzeugt, anstatt einen Mangel.
Phenylcetonurie, eine ungewöhnliche erbliche Krankheit bei Frauen, beeinflusst die hepatische Hydroxylierung von Phenylalanin und macht die Plasmaspiegel dieser Aminosäure übertrieben, so dass eine neuronale Apoptose induziert wird und die normale Entwicklung des Gehirns beeinflusst.
Wenn eine Frau mit Phenylcetonurie schwanger wird, kann der Fötus das sogenannte "Hyperphenylalaninämie mütterlicherseits" -Fetalsyndrom "vorlegen.
Dies liegt daran, dass der Fötus im Blut hohe Phenylalaninkonzentrationen aufweist (fast doppelt so.
Fetales Syndrom durch Hyperphenylalaninämie mütterlich.
Verweise
- Biondi, r., Brancorsini, s., Poli, g., Egidi, m. G., Capodicasa, e., Bottiglieri, l.,… & Micu, r. (2018). Nachweis und Ausfangen von Hydroxylradikal über D-Phenylalaninhydroxylierung in menschlichen Flüssigkeiten. Talanta, 181, 172-181
- Cho, m. H., Korea, o. R., Yang, h., Bedgar, d. L., Laskar, d. D., Anterola, a. M.,… & Kang, c. (2007). Phenylalanin -Biosynthese in Thalian arabidopsis Identifizierung und Charakterung von Argumnat -Dehydratas. Journal of Biological Chemistry, 282 (42), 30827-30835.
- Fernstrom, J. D., & Fernstrom, m. H. (2007). Tyrosin-, Phenylalanin- und Cathocholamin -Synthese und -Funktion im Gehirn. Das Journal of Nutrition, 137 (6), 1539S-1547s.
- Hou, j., Vázquez-González, m., Fadeev, m., Liu, x., Lavi, r., & Willner, ich. (2018). Katalysierte und elektrokatalysierte Oxidation von L-Tyrosin und L-Phenylalanin zu Dopachrom durch Nanozyme. Nano Letters, 18 (6), 4015-4022.
- Nelson, d. L., Lehninger, a. L., & Cox, m. M. (2008). Lehninger Prinzipien der Biochemie. Macmillan.
- Perkins, r., & Vaida, v. (2017). Phenylalanin erhöht die Membranpermeabilität. Journal of the American Chemical Society, 139 (41), 14388-14391.
- Plimmer, r. H. ZU. (1912). Die chemische Konstitution der Proteine (vol. 1). Longmans, grün.
- Tensley, g. (2018). Gesundheit. Abgerufen am 5. September 2018 von www abgerufen.Gesundheit.com/Ernährung/Phenylalanin
- Tohge, t., Watanabe, m., Hoefgen, r., & Fernie, zu. R. (2013). Schikimate- und Phenylalanin -Biosynthese in der grünen Linie. Grenzen in der Pflanzenwissenschaft, 4, 62.
- « Isoleucineigenschaften, Funktionen, Biosynthese, Lebensmittel
- Nationale Frontmerkmale, Ziele, Präsidenten »

