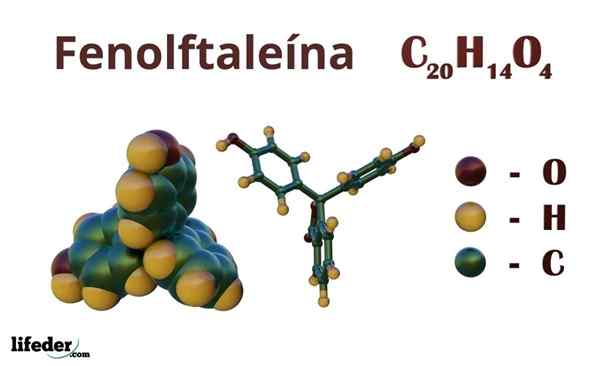
Phenolphthalein (C20H14O4)
- 3986
- 637
- Tizian Liebich
Was ist Phenolphthalein?
Der Phenolphthalein Es handelt. Das heißt, wenn es sich um eine diprotische Säure handelt, können Sie in Lösung zwei H -Ionen verlieren+, Und um ein Indikator zu sein, müssen Sie die Eigenschaft haben, in dem pH -Bereich, der geschätzt wird.
In Basismedium (Ph> 8) ist Phenolphthalein rosa, was zu einem violetten Rot intensiviert werden kann. Um als Säure-Base-Indikator verwendet zu werden, sollten Sie nicht schneller mit OH reagieren- der Umgebung, die analysiert wird, um zu bestimmen.
Da es sich um eine sehr schwache Säure handelt, ist das Vorhandensein der Gruppen -Cooh ausgeschlossen, und daher sind die Quelle von Säureprotonen zwei OH -Gruppen, die mit zwei aromatischen Ringen verbunden sind.
Formel
Phenolphthalein ist eine organische Verbindung, deren kondensierte chemische Formel C istzwanzigH14ENTWEDER4. Obwohl vielleicht nicht ausreicht, um herauszufinden, welche organischen Gruppen besitzt, können Sie aus der Formel die Ungesättigung berechnen, um Ihr Skelett aufzuklären.
Chemische Struktur
 Struktur des Phenolphthaleins
Struktur des Phenolphthaleins Die Struktur des Phenolphthaleins ist dynamisch, was bedeutet, dass sie Änderungen abhängig vom pH -Wert seiner Umgebung erfährt. Im überlegenen Bild wird die Struktur von Phenolphthalein im Bereich von 0 dargestellt Es ist der pentagonale Ring, der die größten Modifikationen erleidet. Zum Beispiel in Basismedium, wenn eine der OH-Gruppen von Phenolringen ihre negative Belastung (-o)-) wird vom aromatischen Ring angezogen, der den Pentagonal Ring in der neuen Anordnung seiner Links "öffnet". Hier befindet sich die neue negative Last in der Gruppe -coo-, das aus dem pentagonalen Ring "abfiel". Nach Erhöhung der Basizität des Medium. Das minderwertige Bild fasst das Ergebnis der beiden Nicht -Deptonierung in Basismedium zusammen. Diese Struktur ist für die vertraute rosa Färbung von Phenolphthalein verantwortlich. Die Elektronen, die durch das konjugierte π -System (dargestellt mit den doppelten Resonanzbindungen) "reisen), absorbieren im sichtbaren Spektrum, speziell zur Wellenlänge der gelben Farbe, und reflektiert die rosa Farbe, die das Auge des Erwarteten erreicht. Phenolphthalein hat insgesamt vier Strukturen. Die beiden vorherigen sind praktisch die wichtigsten und werden abgekürzt wie: H2In und in2-. Phenolphthalein wird in der chemischen Analyse als visueller Indikator bei der Bestimmung des Äquivalenzpunkts bei Neutralisationsreaktionen oder zur Säure-Base-Grad verwendet. Das Reagenz für diese Säure-Base-Bewertungen wird bei 1 % in 90 % Alkohol aufgelöst. Phenolphthalein präsentiert 4 Staaten: Dieses Verhalten hat die Verwendung von Phenolphthalein als Hinweis auf die Kohlensäure von Beton ermöglicht, die den pH -Wert zu einem Wert zwischen 8,5 und 9 unterscheiden. Auch die Färbungsänderung ist sehr abrupt; das heißt das Anion in2- Pink wird mit hoher Geschwindigkeit erzeugt. Infolgedessen können Sie ein Kandidat als Indikator in vielen volumetrischen Bestimmungen sein. Zum Beispiel die einer schwachen Säure (Essigsäure) oder einer starken (Salzsäure). Phenolphthalein wurde als Abführmittel verwendet. Es gibt jedoch eine indikative wissenschaftliche Literatur, dass einige Abführmittel, die Phenolphthalein als aktives Prinzip enthalten, das die Absorption von Wasser und Elektrolyten im Dickdarm, der die Evakuationen fördert, hemmt - negative Wirkungen haben könnte. Die längere Verwendung dieser Medikamente, die Phenolphthalein enthalten. Chemisch modifiziertes Phenolphthalein und wird dann in seinen reduzierten Zustand verwandelt, wird als Reagenz in forensischen Tests verwendet, die es ermöglichen. Es wird durch die Kondensation des phthalischen Anhydrids mit dem Phenol in Gegenwart einer konzentrierten Schwefelsäure und einem Gemisch aus Aluminium und Zinkchloriden als Katalysatoren der Reaktion gebildet: Die aromatische elektrophile Substitution ist der Mechanismus, der diese Reaktion regiert. Woraus besteht es? Der Phenolring (das Molekül der linken) wird dank des an Elektronen reichhaltigen Sauerstoffatoms negativ belast. Andererseits der Kohlenstoff der Gruppe C = o des phthalischen Anhydridens. Der phenolische Ring, reich an Elektronen, greift diesen schlechten Kohlenstoff in Elektronen an und enthält den ersten Ring in die Struktur. Dieser Angriff erfolgt bevorzugt am anderen Ende des Kohlenstoffs, der mit der OH -Gruppe verbunden ist. Dies ist die Position -für. Gleiches gilt für den zweiten Ring: Es greift den gleichen Kohlenstoff an und dank des sauren Mediums wird ein Molekül Wasser erzeugt. Auf diese Weise ist Phenolphthalein nichts weiter als ein phthalisches Anhydridmolekül, das zwei Phenolringe in eine seiner Carbonillus -Gruppen integriert hat (c = o). Sein physikalisches Erscheinungsbild ist das eines weißen Feststoffs mit triklinischen Kristallen, oft agglomeriert oder in Form rhombischer Nadeln. Es handelt-13 mmhg). Es ist sehr wenig löslich in Wasser (400 mg/l), aber sehr löslich in Alkoholen und Äther. Aus diesem Grund wird empfohlen, es in Ethanol zu verdünnen, bevor sie verwendet werden. Es ist in aromatischen Lösungsmitteln wie Benzol und Toluol oder in aliphatischen Kohlenwasserstoffen wie N-Hexan unlöslich. Gefunden bei 262,5 ° C und die Flüssigkeit hat einen Siedepunkt von 557,8 ± 50,0 ° C zum atmosphärischen Druck. Diese Werte deuten auf starke intermolekulare Wechselwirkungen hin. Dies ist auf Wasserstoffbrücken sowie auf die vorderen Wechselwirkungen zwischen den Ringen zurückzuführen. Sein PKA ist 9,7 bis 25 ° C. Dies führt zu einem sehr geringen Trend, sich in wässrigem Medium zu dissoziieren: H2In (ac) + 2h2Oder (l) in2-(Ac) + 2h3ENTWEDER+ Dies ist eine wässrige Balance. Die Zunahme der OH -Ionen- In der Lösung nimmt die gegenwärtige Menge an h ab3ENTWEDER+. Folglich bewegt sich das Gleichgewicht nach rechts, um mehr h zu produzieren3ENTWEDER+. Auf diese Weise wird sein anfänglicher Verlust belohnt. Wenn mehr Basis hinzugefügt wird, bewegt sich das Gleichgewicht weiter nach rechts und so weiter, bis nichts von der Art h ist2In. Zu diesem Zeitpunkt die Spezies in2- Rosado Farbe die Lösung. Schließlich zersetzt sich Phenolphthalein beim Erhitzen, Ausstreben eines Hektars und irritierender Rauch.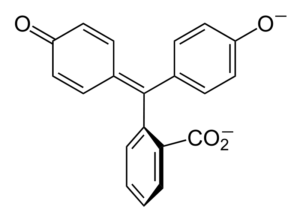
Verwendet/Anwendungen von Phenolphthalein
 Hinzufügen alkalischer Lösung zu neutraler Lösung mit Phenolphthaleinindikator
Hinzufügen alkalischer Lösung zu neutraler Lösung mit Phenolphthaleinindikator Indikatorfunktion
Verwendung in der Medizin
Phenolphthaleinsynthese
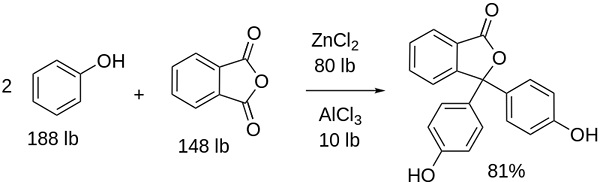
Phenolphthaleineigenschaften
Verweise