Zwischenfilamente Struktur, Typen, Funktionen
- 3320
- 212
- Timo Rabenstein
Der Zwischenfilamente, Auch in der Literatur als „IFs“ bekannt (aus Englisch Zwischenfilamen), sind eine Familie unlöslicher zytosolischer fibröser Proteine, die in allen multizellulären eukaryotischen Zellen vorhanden sind.
Sie sind Teil des Zytoskeletts, einem intrazellulären filamentösen Netzwerk, das hauptsächlich für die Unterstützung der Zellstruktur und verschiedene metabolische und physiologische Prozesse wie den Transport von Vesikeln, Bewegung und Zellverschiebung usw. verantwortlich ist.
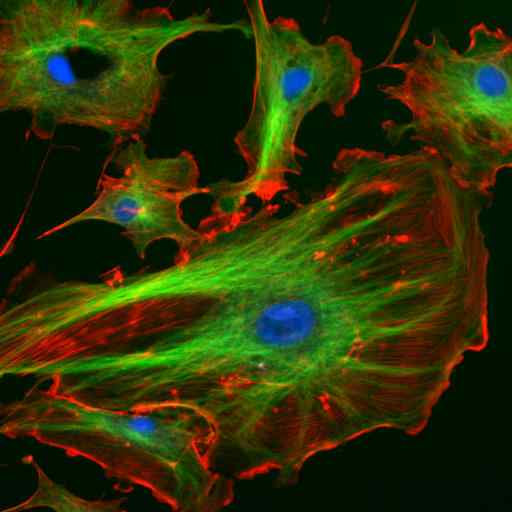
 Mikroskopie durch Immunfluoreszenz zweier Proteine der Zwischenfilamente von Astrozyten (Vimentina und GFAP) (Quelle: Gerryshaw [CC BY-SA 3.0 (https: // creativecommons.Org/lizenzen/by-sa/3.0)] über Wikimedia Commons)
Mikroskopie durch Immunfluoreszenz zweier Proteine der Zwischenfilamente von Astrozyten (Vimentina und GFAP) (Quelle: Gerryshaw [CC BY-SA 3.0 (https: // creativecommons.Org/lizenzen/by-sa/3.0)] über Wikimedia Commons) Zusammen mit Mikrotubuli und Mikrofilamenten beteiligen sich Zwischenfilamente an der räumlichen Organisation von intrazellulären Organellen, an Endozytose- und Exozytoseprozessen sowie in den Prozessen der Zellteilung und interzellulären Kommunikation.
Die ersten mittleren Filamente, die untersucht und beschrieben wurden.
Das Konzept der Zwischenfilamente wurde jedoch in den 1980er Jahren von Lazarides eingeführt, die sie als "mechanische Integratoren des Zellraums" bezeichneten, die durch ihre Inlöslichkeit und ihre Fähigkeit zur Wiederherstellung gekennzeichnet sind In vitro Nach seiner Denaturierung.
Viele Autoren gelten als "Dämpfung" -Eremente von Stress für tierische Zellen, da sie flexiblere Filamente als Mikrotubuli und Mikrofilamente sind. Sie sind nicht nur im Zytoskelett vorhanden.
Im Gegensatz zu den anderen fibrösen Komponenten des Zytoskelettons beteiligen sich Zwischenfilamente nicht direkt an Zellmobilitätsprozessen, sondern arbeiten in struktureller Aufrechterhaltung und mechanischer Resistenz von Zellen.
[TOC]
Struktur
 Quelle: http: // rsb.Die Info.NIH.GOV/IJ/Images/[Public Domain]
Quelle: http: // rsb.Die Info.NIH.GOV/IJ/Images/[Public Domain] Die Zwischenfilamente haben einen ungefähren Durchmesser von 10 nm, ein strukturelles Merkmal, durch das sie benannt wurden, da ihre Größe zwischen den Größen der Myosin- und Aktinfilamente entspricht, die etwa 25 nm bzw. 7 nm liegen.
Sie unterscheiden sich strukturell von den beiden anderen Arten von Zytoskelettfilamenten, bei denen es sich um globuläre Proteinpolymere handelt, bei denen ihre Bestandteile unterschiedliche α-helikoidale fibröse Proteine von großer Länge sind, die voneinander gruppiert sind, um Strukturen in Form von Seil oder Seil zu bilden.
Alle Proteine, die die Zwischenfilamente ausmachen.
Diese helikale Domäne wird von einem nicht terminalen "Kopf" und einem nicht hypoidalen "Schwanz" am C-terminalen Ende flankiert. Beide variieren sowohl in Größe als auch Aminosäuresequenz.
Innerhalb der Abfolge dieser beiden Extreme sind die Konsensgründe, die für 6 Arten bekannter Zwischenfilamente üblich sind.
In Wirbeltieren hat die „Seil“ -Domäne des Proteins der intermediären zytosolischen Filamente etwa 310 Aminosäureabfälle, während die zytosolischen Proteine der Wirbellosen und des Kernlaminats etwa 350 Aminosäuren lang sind.
Kann Ihnen dienen: Reptilien: Was sind, Eigenschaften, Klassifizierung, ReproduktionMontage
Zwischenfilamente sind "Self -Assembly" -Strukturen, die keine enzymatische Aktivität haben, die sie auch von ihren Zytoskelett -Gegenstücken (Mikrotubuli und Mikrofilamente) unterscheidet.
Diese Strukturen werden ursprünglich als Tetramere filamentöse Proteine zusammengestellt, die sie unter dem Einfluss nur einwertiger Kationen umfassen.
Diese Tetramere sind 62 nm lang und ihre Monomere sind seitlich miteinander verbunden, um die "Längeneinheiten" (UFL, Englisch zu bilden Einheiten-LLEGTH-Filme), Was als Phase 1 der Baugruppe bekannt ist, die sehr schnell auftritt.
Die UFLs sind die Vorläufer der langen Filamente und da die Dimere, die sie umfassen von anderen UFLs wird gegeben.
Während der sogenannten Phase 3 der Baugruppe erfolgt die radiale Verdichtung des Durchmessers der Filamente, der die reifen Zwischenfilamente von mehr oder weniger Durchmesser von 10 nm erzeugt.
Funktionen
Die Funktionen der Zwischenfilamente hängen erheblich von der Art der Zelle ab, die berücksichtigt wird, und im Fall von Tieren (einschließlich Menschen) wird ihr Ausdruck auf gewebespezifische Weise reguliert, sodass sie auch von der Art des Gewebes als unter abhängt lernen.
Epithelien, Muskeln, Mesenchymale und Gläals und Neuronen haben unterschiedliche Arten von Filamenten, die nach der Funktion der Zellen spezialisiert sind, zu denen sie gehören.
Unter diesen Funktionen sind die wichtigsten die strukturelle Aufrechterhaltung von Zellen und Resistenz gegen unterschiedliche mechanische Spannungen, da diese Strukturen eine gewisse Elastizität aufweisen, die es ihnen ermöglicht, verschiedene Arten von Kräften zu feuchten, die den Zellen auferlegt werden.
Arten von Zwischenfilamenten
Proteine, die mittlere Filamente bilden, gehören zu einer großen und heterogenen Familie filamentöser Proteine, die chemisch unterschiedlich sind, aber in sechs Klassen gemäß ihrer Homologie der Sequenzen unterschieden werden (I, II, III, IV, V und VI).
Obwohl es nicht sehr verbreitet ist, sind verschiedene Arten von Zellen unter sehr bestimmten Bedingungen (Entwicklung, Zelltransformation, Wachstum usw.) Sie können mehr als eine Klasse von Intermediaten-Filamentproteinen zusammenpressen
Klasse I und II von Zwischenfilamenten: Säure und Basiskeratine
Die Keratine repräsentieren die meisten Proteine von Zwischenfilamenten und beim Menschen mehr als drei Viertel der Zwischenfilamente.
Sie haben molekulare Gewichte, die zwischen 40 und 70 kDa variieren und sich aufgrund ihres hohen Gehalts in Glycin und Serin von anderen Zwischenfilamentproteinen unterscheiden.
Kann Ihnen dienen: Igel: Eigenschaften, Lebensraum, Reproduktion, LebensmittelSie sind für ihre isoelektrischen Punkte, die zwischen 4 liegen, als Säure- und Basiskeratine bekannt.9 und 5.4 für saure Keratine und zwischen 6.1 und 7.8 für Grundlagen.
In diesen beiden Klassen wurden etwa 30 Proteine beschrieben und sind insbesondere in Epithelzellen vorhanden, in denen beide Arten von Protein "colimerisieren" und zusammengesetzte Filamente bilden.
Viele der Fall -I -Keratine von Zwischenfilamenten sind in Strukturen wie Haaren, Nägeln, Hörnern, Spikes und Krallen vorhanden, während Klasse II in Cytosol am häufigsten vorkommt.
Klasse III von Zwischenfilamenten: Demine/Vimentin -Proteine vom Typ
The Falls ist ein saures Protein von 53 kDa, das je nach Phosphorylierungsgrad unterschiedliche Varianten aufweist.
Einige Autoren haben auch Filamente des Sturzes als "Muskelintermediatfilamente" bezeichnet, da ihre Anwesenheit ziemlich eingeschränkt ist, obwohl in kleinen Mengen alle Arten von Muskelzellen.
In Myofibrillen befindet sich die Falls in Zeile Z, so dass dieses Protein zu den kontraktilen Funktionen von Muskelfasern bei der Arbeit in der Vereinigung von Myofibrillas und Plasmamembran beiträgt.
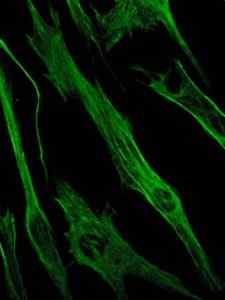 Foto der Färbung des Vimentinproteins, eines Proteins der Zwischenfilamente der epithelialen und embryonalen Zellen (Quelle: Viktoriia kosach [CC BY-SA 4.0 (https: // creativecommons.Org/lizenzen/by-sa/4.0)] über Wikimedia Commons)
Foto der Färbung des Vimentinproteins, eines Proteins der Zwischenfilamente der epithelialen und embryonalen Zellen (Quelle: Viktoriia kosach [CC BY-SA 4.0 (https: // creativecommons.Org/lizenzen/by-sa/4.0)] über Wikimedia Commons) Vimentin ist ein Protein, das in mesenchymalen Zellen vorhanden ist. Die durch dieses Protein gebildeten Zwischenfilamente sind flexibel und es wurde festgestellt, dass sie vielen der Konformationsänderungen widerstehen, die während des Zellzyklus auftreten.
Es wird in Fibroblasten, in glatten Muskelzellen, in weißen Blutkörperchen und anderen Zellen des tierischen Kreislaufsystems gefunden.
Klasse IV von Zwischenfilamenten: Neurofilamentöse Proteine
Diese Art von Zwischenfilamenten, auch als "Neurofilamente" bekannt, umfasst eines der grundlegenden strukturellen Elemente von Axonen und neuronalen Dendriten; Sie sind oft mit den Mikrotubuli verbunden, aus denen auch diese Strukturen bestehen.
Neurofilamente von Tieren von Wirbeltieren wurden isoliert, was feststellte, dass es sich um ein 200-, 150- und 68 kDa -Protein -Triplett handelt In vitro.
Sie unterscheiden.
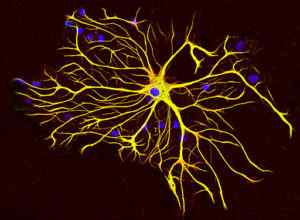
Gliazellen produzieren eine spezielle Art von Zwischenfilamenten.
Klasse V der Zwischenfilamente: Kernschildfilamente
Alle Blätter, die Teil der Nucleosqueletto sind, sind tatsächlich Zwischenfilamentproteine. Diese haben zwischen 60 und 75 kDa Molekulargewicht und befinden sich in den Kernen aller eukaryotischen Zellen.
Kann Ihnen dienen: Trichuris TrichiuraSie sind für die interne Organisation der Kernregionen und für viele der Funktionen dieser wesentlichen Organelle für die Existenz von Eukaryoten von wesentlicher Bedeutung.
Klasse VI von Zwischenfilamenten: Nestinen
Diese Art von Zwischenfilamenten wiegt mehr oder weniger 200 kDa und befindet sich vorwiegend in den Stammzellen des Zentralnervensystems. Sie werden während der neuronalen Entwicklung exprimiert.
Verwandte Pathologien
Es gibt mehrere Krankheiten bei Menschen, die sich auf Zwischenfilamente beziehen.
In einigen Krebsarten wie malignen Melanomen oder Brustkarzinomen beispielsweise führt die Koexpression von Zwischenvimentin- und Keratinfilamenten zur Differenzierung oder Interkonversion von Epithel- und Mesenchymzellen.
Es wurde experimentell gezeigt, dass dieses Phänomen die wandernde und invasive Aktivität von Krebszellen erhöht, was wichtige Auswirkungen auf metastatische Prozesse hat, die für diesen Zustand charakteristisch sind.
Eriksson und Mitarbeiter (2009) überprüfen die verschiedenen Arten von Krankheiten und ihre Beziehung zu spezifischen Mutationen in den Genen, die an der Bildung der sechs Arten von Zwischenfilamenten beteiligt sind.
Krankheiten, die mit der kodierenden Genmutationen für die beiden Arten von Keratin zusammenhängen.
Zwischenfilamente vom Typ III sind an zahlreichen Kardiomyopathien und verschiedenen Muskelerkrankungen beteiligt, die hauptsächlich mit Dystrophien zusammenhängen. Darüber hinaus sind sie auch für dominante Katarakte und einige Arten von Sklerose verantwortlich.
Zahlreiche neurologische Syndrome und Störungen hängen mit Typ -IV -Filamenten wie Parkinson Parkinson zusammen. In ähnlicher Weise sind genetische Defekte in Typ -V- und Vi -Filamenten für die Entwicklung verschiedener autosomaler Erkrankungen verantwortlich und im Zusammenhang mit der Funktionsweise des Zellkerns verbunden.
Beispiel hierfür sind unter anderem Hutchinson-Gilford Progeria-Syndrom, Emery-Dreifuss-Muskeldystrophie.
Verweise
- Anderton, geb. H. (1981). Zwischenfilamles: Eine Familie homologen Strukturen. Zeitschrift für Muskelforschung und Zellmotilität, 2(2), 141-166.
- Eriksson, J. UND., Pallari, h., Robert, d., Eriksson, J. UND., DeChat, t., Grinsen, b.,… Goldman, r. D. (2009). Einführung von Zwischenfilamoren: Von der Entdeckung zur Krankheit. Das Journal of Clinical Investigation, 119(7), 1763-1771.
- Fuchs, e., & Weber, k. (1994). Zwischenfilamles: Struktur, Dynamik, Funktion und Krankheit. Annu. Rev. Biochem., 63, 345-382.
- Hendrix, m. J. C., Seftor, e. ZU., Chu und. W., Trevor, k. T., & Seftor, r. UND. B. (neunzehn sechsundneunzig). Rolle von Zwischenfüllungen bei Migration, Invasion und Metastasierung. Krebs- und Metastasierungsprüfungen, fünfzehn(4), 507-525.
- Herrmann, h., & Aebi, u. (2004). Zwischenfilames: Molekulare Struktur, Montagemechanismus und Integration in funktionell intrazelluläre Gerüste unterschiedlich. Jährliche Überprüfung der Biochemie, 73(1), 749-789.
- Herrmann, h., & Aebi, u. (2016). Zwischenfilamles: Struktur und Montage. Cold Spring Harbor Perspektiven in Biologie, 8, 1-22.
- McLean, ich., & Lane, b. (1995). Zwischenfilamoren in Diew. Aktuelle Meinung in der Zellbiologie, 7(1), 118-125.
- Steinert, p., & Roop, D. (1988). Molekular- und Zellbiologie von Zwischenfilmen. Jährliche Überprüfung der Biochemie, 57(1), 593-625.
- Steinert, p., Jones, J., & Goldman, r. (1984). Zwischenfilamen. Das Journal of Cell Biology, 99(1), 1-6.
- « Gastrotriceigenschaften, Lebensraum, Reproduktion, Nahrung
- Merkmale der weichen Moschee, Taxonomie, Lebensraum, verwendet »

