Fluoror -Anamnese, Eigenschaften, Struktur, erhalten, Risiken, verwendet
- 4468
- 1294
- Luca Holdt
Er Fluor Es ist ein chemisches Element, das mit dem F -Symbol und der Kopfgruppe 17 dargestellt wird, zu der die Halogene gehören. Es zeichnet sich über den anderen Elementen des Periodenzüchtertabels als reaktiv und elektronegativ aus. reagiert fast mit allen Atomen, so dass es unzählige Salze und organisatorische Verbindungen bildet.
Unter normalen Bedingungen handelt es sich um ein blassgelbes Gas, das mit gelblichem Grün verwechselt werden kann. Im flüssigen Zustand, der im unteren Bild gezeigt ist, verschärft sich seine gelbe Farbe etwas mehr, was vollständig verschwindet, wenn sie sich in seinem Gefrierpunkt verfestigt.
 Flüssigfluor in einem Reagenzglas. Quelle: Fulvio314 [CC BY-SA 3.0 (https: // creativecommons.Org/lizenzen/by-sa/3.0)]]
Flüssigfluor in einem Reagenzglas. Quelle: Fulvio314 [CC BY-SA 3.0 (https: // creativecommons.Org/lizenzen/by-sa/3.0)]] Es ist eine solche Reaktivität, trotz des volatilen Gases, das in der Erdkruste gefangen bleibt. vor allem in Form von Fluoritenmineral, bekannt für seine violetten Kristalle. Ebenso macht es seine Reaktivität zu einer potenziell gefährlichen Substanz. Reagieren Sie kräftig mit allem, was in Flammen berührt und brennt.
Viele seiner abgeleiteten Produkte können jedoch harmlos und sogar vorteilhaft sein, abhängig von ihren Anwendungen. Zum Beispiel besteht die beliebteste Verwendung von Fluorid, die in seiner ionischen oder mineralischen Form (wie Fluoridsalze) hinzugefügt wird.
Fluor zeigt die Besonderheit, dass hohe Zahlen oder Oxidationszustände für viele andere Elemente stabilisieren können. Je größer die Anzahl der Fluoratome ist, desto reaktiver wird die Verbindung (es sei denn, es handelt sich um ein Polymer). Ebenso nehmen seine Wirkungen mit molekularen Matrizen zu; wohl oder übel.
[TOC]
Geschichte
Verwendung von Fluorit
1530 entdeckte der deutsche Mineralogist Georgius Agricola, dass bei der Metallreinigung Fluorspat Mineral verwendet werden konnte. Fluorspat ist ein anderer Name für Fluorit, ein Fluormineral, das aus Calciumfluorid (CAF) bestand2).
Das Fluorelement war bis dahin nicht entdeckt worden, und das "Fluoir" im Fluorit stammte aus dem lateinischen Wort "fluere", was "Fluss" bedeutet; Da das Fluorspar oder Fluorit mit Metallen gemacht hat: Es half ihnen, die Probe zu verlassen.
Herstellung von Fluorhorsäure
1764 verwaltete Andreas Sigismud Margraff. Glas kehrt durch die Wirkung von Säure zurück, so dass das Glas durch Metalle ersetzt wurde.
Es wird auch Carl Scheele im Jahr 1771 zugeschrieben, die Herstellung von Säure nach derselben Methode, gefolgt von Margraff. Im Jahr 1809 schlug der französische Wissenschaftler Andre-Marie Ampere vor, dass Fluor- oder Fluorsäure eine durch Wasserstoff gebildete Verbindung und ein neues Element ähnlich wie Chlor war.
Wissenschaftler versuchten, Fluor durch die Verwendung von fluorhorischer Säure für lange Zeit zu isolieren. Aber seine Gefahr machte diesbezüglich Fortschritte.
Humphry Davy, Joseph Louis Gay-Lussac und Jacques Thénard hatten starke Schmerzen beim Einatmen des Wasserstofffluorids (Fluoridsäure ohne Wasser und in gasförmiger Form))). Unter ähnlichen Umständen starben die Wissenschaftler Paulin Louyet und Jerome Nickles durch Vergiftung.
Edmond Fréme, französischer Forscher, versuchte, trockene Fluorhoridsäure zu erzeugen, um die Toxizität von Wasserstofffluorid durch Ansäuerung von Kaliumbifluorid (KHF) zu vermeiden2), Aber während der Elektrolyse gab es keine elektrische Stromleitung.
Isolation
1860 versuchte der englische Chemiker George Gore. Es gab jedoch eine Explosion durch heftiges Rekombination von Wasserstoff mit Fluorid. Gore führte die Explosion auf eine Sauerstoffleckage zurück.
1886 gelang es dem französischen Chemiker Henri Moisson zum ersten Mal Fluorid. Zuvor wurde Moissons Arbeit viermal aufgrund einer schweren Vergiftung mit Wasserstofffluorid unterbrochen, während er versuchte, das Element zu isolieren.
Moisson war ein heiligster Student und basierte auf seinen Experimenten, um Fluorid zu isolieren. Moisson in Elektrolyse Ein Gemisch aus Kaliumfluorid und Fluorhorsäure verwendet. Die resultierende Lösung führte Elektrizität und Fluorgas an, die sich in der Anode angesammelt haben; Das heißt in der positiv beladenen Elektrode.
Moisson verwendete eine korrosionsresistente Ausrüstung, bei der die Elektroden aus einer Platin- und Iridiumlegierung bestehen. In der Elektrolyse wurde ein Platinbehälter verwendet und die elektrolytische Lösung bei einer Temperatur von -23 ºF (-31 ºC) abgekühlt.
Am 26. Juni 1886 gelang es Henri Moisson schließlich, Fluorid zu isolieren, eine Arbeit, die es ihm ermöglichte, 1906 den Nobelpreis zu gewinnen.
Interesse an Fluorid
Für eine Weile ging das Interesse an Untersuchungen mit Fluorid verloren. Die Entwicklung des Manhattan -Projekts zur Herstellung der Atombombe.
Das American Company DuPont entwickelte zwischen 1930 und 1940 fluorierte Produkte wie Chlorfluorokarbonate (Freon-12), die als Kältemittel verwendet wurden. und Polythetrafluorethylen -Kunststoff, am besten mit dem Namen Teflon bekannt. Dies führte zu einem Anstieg der Fluorproduktion und des Verbrauchs.
1986 auf einer Konferenz für ein Jahrhundert Fluorisolation der amerikanische Chemiker Karl oder. Christen präsentierte eine chemische Methode zur Herstellung von Fluorid durch Reaktion zwischen k2Mnf6 und der SBF5.
Kann Ihnen dienen: PolyvinylalkoholPhysikalische und chemische Eigenschaften
Aussehen
Fluor ist ein hellgelbes Gas. In flüssigem Zustand ist es leuchtend gelb. In der Zwischenzeit kann der Feststoff undurchsichtig (Alpha) oder transparent (Beta) sein.
Atomnummer (z)
9.
Atomares Gewicht
18.998 u.
Schmelzpunkt
-219,67 ºC.
Siedepunkt
-188.11 ºC.
Dichte
Bei Raumtemperatur: 1.696 g/l.
Am Schmelzpunkt (Flüssigkeit): 1.505 g/ml.
Verdampfungswärme
6,51 kJ/mol.
Molkalorienkapazität
31 j/(mol · k).
Dampfdruck
Bei einer Temperatur von 58 K hat einen Dampfdruck von 986,92 atm.
Wärmeleitfähigkeit
0,0277 w/(m · k)
Magnetische Ordnung
Diamagnetisch
Geruch
Würziger und durchdringender charakteristischer Geruch, nachweisbar auch bei 20 ppb.
Oxidationszahlen
-1, was Fluoridanion entspricht, F-.
Ionisationsenergie
-Erstens: 1.681 kJ/mol
-Zweitens: 3.374 kJ/mol
-Dritte: 6.147 kJ/mol
Elektronegativität
3.98 auf der Paulingskala.
Es ist das chemische Element mit den größten Elektronegativitäten; Das heißt, es hat eine hohe Affinität zu den Elektronen der Atome, mit denen es verbunden ist. Aus diesem Grund erzeugen Fluoratome große Dipolmomente in bestimmten Regionen eines Moleküls.
Seine Elektronegativität hat auch einen weiteren Effekt: Atome, die mit ihm verbunden sind, verlieren so viel elektronische Dichte, dass sie beginnen, eine positive Belastung zu erwerben; Dies ist eine positive Oxidationszahl. Je mehr Fluoratome in einer Verbindung.
Zum Beispiel in der von2 Sauerstoff hat eine Oxidationszahl von +2 (oder2+F2-); In der UF6, Uran hat eine Oxidationszahl von +6 (u6+F6-); Gleiches gilt für Schwefel im SF6 (S6+F6-); Und schließlich ist die AgF2, Wo Silber sogar eine Oxidationszahl von +2 hat, ungewöhnlich darin.
Daher gelingt es den Elementen, an ihren positivsten Oxidationszahlen teilzunehmen, wenn sie Verbindungen mit Fluorid bilden.
Oxidationsmittel
Fluor ist das leistungsstärkste oxidierende Element, daher kann es keine Substanz oxidieren. Und aus diesem Grund ist er in der Natur nicht frei.
Reaktivität
Fluor kann sich mit allen anderen Elementen kombinieren, außer mit Helium, Neon und Argon. Es greift auch bei normalen Temperaturen auch keinen süßen Stahl oder Kupfer an. Reagieren Sie heftig mit organischen Materialien wie Gummi, Holz und Stoff.
Das Fluorid kann mit dem edlen Gas -Xenon reagieren, um das starke Differenzoxidationsmittel von Xenon, XEF, zu bilden2. Es reagiert auch mit Wasserstoff, um ein Halogenid, Wasserstofffluorid, HF zu bilden. Wasserstofffluorid wird wiederum in Wasser gelöst, um die berühmte Fluorhorsäure (Glas essen) zu erzeugen.
Die Säure von Hydracesäuren, die in zunehmender Reihenfolge eingestuft werden, lautet:
Hf < HCl < HBr < HI
Salpetersäure reagiert mit Fluorid zu Fluornitrat, FNO3. In der Zwischenzeit reagiert Salzsäure energisch mit Fluorid auf HF, von2 und Clf3.
Elektronische Struktur und Konfiguration

Diatommolekül
 Fluoridmolekül, das mit Raumfüllungsmodell dargestellt wird. Quelle: Gabriel Bolívar.
Fluoridmolekül, das mit Raumfüllungsmodell dargestellt wird. Quelle: Gabriel Bolívar. Das Fluor -Atom in seinem Grundzustand hat sieben Elektronen Valencia, die gemäß der elektronischen Konfiguration in den Orbitalen 2s und 2p liegen:
[Er] 2s2 2 p5
Die Valencia Link Theory (TEV) legt fest, dass zwei Fluoratome, F, kovalent miteinander verbunden sind, um ihr Oktett in Valencia abzuschließen.
Dies tritt schnell auf, da es kaum ein Elektron fehlt, um isolektronisch zu edelnem Neongas zu werden. Und seine Atome sind sehr klein, mit einer sehr starken effektiven Kernbelastung, die leicht Elektronen der Umwelt erfordert.
Das Molekül f2 (Überlegenes Bild) hat einen einfachen kovalenten Link, F-F,. Trotz seiner Stabilität im Vergleich zu freien F -Atomen ist es ein extrem reaktives Molekül. Homonuklear, apolar und nach Elektronen bestrebt. Deshalb Fluorid wie f2, Es ist eine sehr giftige und gefährliche Art.
Weil die f2 Es ist apolar, seine Wechselwirkungen hängen von seiner molekularen Masse und den Londoner Dispersionskräften ab. Irgendwann muss die elektronische Wolke um beide F -Atome einen sofortigen Dipol verformen und entstehen, der in einem benachbarten Molekül ein anderes induziert. so dass sie langsam und schwach sind.
Flüssig und fest
Das Molekül f2 Es ist sehr klein und verbreitet sich im Raum mit relativer Geschwindigkeit. In seiner Gasphase zeigt es eine hellgelbe Farbe (die mit einem Limettengrün verwechselt werden kann). Wenn die Temperatur auf -188 ºC sinkt, werden die Dispersionskräfte wirksamer und machen die Moleküle f f2 Zusammenhalt genug, um eine Flüssigkeit zu definieren.
Das flüssige Fluor (erstes Bild) sieht noch mehr gelb aus als sein jees Gas. Darin, die Moleküle f2 Sie sind näher und interagieren in größerem Maße mit dem Licht. Interessanterweise verblasst die Farbe, sobald das verzerrte Kubikglas von Fluor bis -220 ° C gebildet wird und ein transparentes Feststoff bleibt.
Kann Ihnen dienen: verzweigte AlkaneJetzt, wo die M -Moleküle2 Sie sind so nah (aber ohne ihre molekularen Rotationen stoppen), dass ihre Elektronen etwas Stabilität verdienen, und daher ist ihr elektronischer Sprung zu groß, als dass das Licht überhaupt mit dem Glas interagieren kann.
Kristalline Phasen
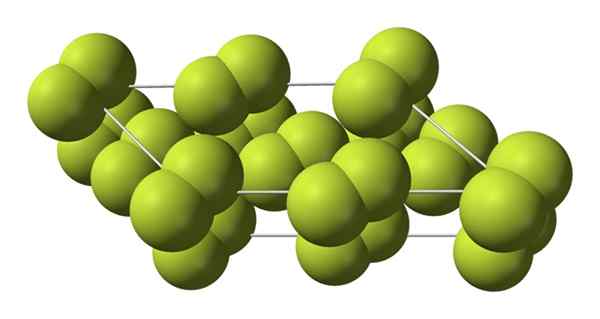
Dieser kubische Kristall entspricht der β -Phase (es ist keine alotrope, da er gleich bleibt2). Wenn die Temperatur um noch mehr abnimmt, bis zu -228 ºC, erleidet das feste Fluor einen Phasenübergang; Das Kubikglas wird in eine monoklinische, die α -Phase verwandelt:
 Kristalline Struktur der Alpha -Phase von Fluor. Quelle: Benjah-BMM27 [Public Domain].
Kristalline Struktur der Alpha -Phase von Fluor. Quelle: Benjah-BMM27 [Public Domain]. Im Gegensatz zu β-F2, Die α-F2 ist undurchsichtig und hart. Vielleicht liegt es daran, dass die M -Moleküle2 Sie haben keine solche Freiheit mehr, in ihren festen Positionen in monoklinen Kristallen zu drehen; wo sie in größerem Maße mit dem Licht interagieren, ohne ihre Elektronen zu erregen (was ihre Deckkraft oberflächlich erklären würde).
Die kristalline Struktur von α-F2 Es war schwierig, durch konventionelle X -Strahlenbeugungsmethoden zu untersuchen. Dies liegt daran, dass der Übergang von Phase β zu α sehr exotherm ist; Der Kristall nutzte also praktisch aus, während er wenig mit Strahlung interagierte.
Sie verbrachten ungefähr fünfzig Jahre vor deutschen Wissenschaftlern (Florian Kraus und Mitarbeitern) und entschlüsseln die α-F-Struktur vollständig2 mit größerer Präzision dank Neutronenbeugungstechniken.
Wo ist es und erhalten
Fluor nimmt das 24. der häufigsten Elemente im Universum ein. Auf der Erde ist jedoch in der Masse die 13vo Element mit einer Konzentration von 950 ppm in der Erdkruste und einer Konzentration von 1,3 ppm in Meerwasser.
Die Böden haben eine Fluorkonzentration zwischen 150 und 400 ppm, und auf einigen Böden kann die Konzentration 1 erreichen.000 ppm. In der atmosphärischen Luft ist es in einer Konzentration von 0,6 ppb vorhanden; Aber es hat sich in einigen Städten bis zu 50 ppb registriert.
Fluor wird hauptsächlich aus drei Mineralien erhalten: Fluorit oder Fluorospat (Kaffee2), Die Fluoroapatita [CA5(Po4)3F] und das kreol (na3Alf6).
Fluoritverarbeitung
Nach dem Sammeln der Felsen mit dem Fluoritenmineral unterliegen diese primäre und sekundäre Zerkleinern. Mit der sekundären Quetschrift von sehr kleinen Gesteinsfragmenten.
Dann werden Gesteinsfragmente zur Staubreduktion in eine Kugelmühle gebracht. Wasser und Reagenzien werden hinzugefügt, um eine Paste zu bilden, die in einem Flotationstank platziert ist. Es wird Druck zur Bildung von Blasen injiziert, und somit landet der Fluorit auf der wässrigen Oberfläche.
Silikate und Carbonate sind Sediment, während Fluorit gesammelt wird und zu Trocknenöfen führt.
Sobald der Fluorit erhalten ist, wird er mit Schwefelsäure umgesetzt, um Wasserstofffluorid zu produzieren:
CAF2 + H2SW4 => 2 HF +Fall4
Wasserstofffluoridelektrolyse
In der Fluoridproduktion werden einige Modifikationen befolgt, wobei die von Moisson 1886 verwendete Methode verwendet wird.
Eine Elektrolyse eines Gemisches aus geschmolzenem Kaliumfluorid und Fluohydsäure wird hergestellt, mit einem molaren Radius von 1: 2,0 bis 1: 2,2. Die geschmolzene Salztemperatur beträgt 70 - 130 ºC.
Die Kathode besteht aus einer Monet- oder Stahllegierung, und die Anode besteht. Der Fluorproduktionsprozess während der Elektrolyse kann wie folgt schematisiert werden:
2HF => H2 + F2
Wasser wird verwendet, um die Elektrolysekammer abzukühlen, aber die Temperatur muss über dem Schmelzpunkt des Elektrolyten liegen, um eine Verstimmung zu vermeiden. Die in der Elektrolyse erzeugte Wasserstoff wird in der Kathode gesammelt, während Fluorid in der Anode.
Isotope
Das Fluorid hat 18 Isotope, die die sind 19F Das einzige stabile Isotop mit 100% Häufigkeit. Er 18F hat ein halbes Leben von 109,77 Minuten und ist das radioaktive Isotop von Fluor mit dem größten halben Leben. Er 18F Es wird als Positronenquelle verwendet.
Biologisches Papier
Es ist keine metabolische Aktivität von Fluor bei Säugetieren oder Oberpflanzen bekannt. Einige Meerestellen und Schwämme synthetisieren jedoch Monofluroacetat, eine giftige Verbindung, die als Schutz verwendet wird, um Zerstörung zu vermeiden.
Risiken
Übermäßiger Fluorkonsum wurde bei Erwachsenen und Zahnfluorose bei Kindern sowie mit Veränderungen der Nierenfunktion in Verbindung gebracht. Aus diesem Grund schlug der US Public Health Service (PHS) der Vereinigten Staaten vor, dass die Fluoridkonzentration in Trinkwasser nicht größer als 0,7 mg/l sein sollte.
In der Zwischenzeit stellte die US Enviromental Protection Agency (EPA) fest, dass die Konzentration von Fluorid in Trinkwasser nicht größer als 4 mg/l betragen sollte, um Skelettfluorose zu vermeiden, bei dem sich Fluorid in den Knochen ansammelt. Dies kann zu einer Schwächung von Knochen und Frakturen führen.
Fluor wurde mit einer Schädigung der Nebenschilddrüse mit einer Abnahme von Kalzium in Knochenstrukturen und hohen Calciumkonzentrationen im Plasma zusammenhängen.
Es kann Ihnen dienen: LEBENS MATERE: Konzept, Merkmale und BeispieleZu den Veränderungen, die auf überschüssiges Fluor zugeschrieben werden.
Zahnfluorose
Zahnfluorose wird mit kleinen Streifen oder Motorrädern im Zahnschmelz präsentiert. Kinder unter 6 sollten keinen Mundwasser mit Fluorid verwenden.
Skelettfluorose
In Skelettfluorose können Schmerzen und Schäden sowie in den Gelenken diagnostiziert werden. Der Knochen kann Elastizität aushärten und verlieren, was das Risiko von Frakturen erhöht.
Anwendungen
Zahnpasta
 Einige anorganische Fluoridsalze werden als Additiv bei der Formulierung von Zahnpasten verwendet, die gezeigt haben, dass sie zum Schutz des Zahnschmelzes beitragen. Quelle: pxhere.
Einige anorganische Fluoridsalze werden als Additiv bei der Formulierung von Zahnpasten verwendet, die gezeigt haben, dass sie zum Schutz des Zahnschmelzes beitragen. Quelle: pxhere. Wir beginnen mit dem Abschnitt der Verwendungen für Fluorid mit dem bekanntesten: als Bestandteil vieler Zahnpasten zu dienen. Dies ist nicht die einzige Verwendung, bei der der Kontrast zwischen seinem Molekül F zu sehen ist2, extrem giftig und gefährlich und Anion f-, welche abhängig von seiner Umgebung vorteilhaft sein kann (obwohl manchmal nicht).
Wenn wir Nahrung essen, insbesondere Süßigkeiten, degradieren Bakterien sie, indem wir die Säure unseres Speichels erhöhen. Dann gibt es einen Punkt, an dem der pH -Wert ausreicht, um den Zahnschmelz zu verschlechtern und zu entmüssen. Hydroxiapatit kommt "runter".
In diesem Prozess jedoch die Ionen f- interagieren mit ca2+ um eine Fluorapatitmatrix zu bilden; stabiler und dauerhafter als Hydroxyapatit. Zumindest ist dies der vorgeschlagene Mechanismus, um die Wirkung des Fluoridanions auf die Zähne zu erklären. Es ist wahrscheinlich, dass es komplexer ist und dass ein Hydroxyapatit-Fluorapatit von pH abhängig ist.
Diese Anionen f- Sie sind in Zahnpapas in Salzen erhältlich; wie: naf, snf2 (Das berühmte Stine -Fluorid) und Nort. Die Konzentration von F jedoch- Es muss niedrig sein (weniger als 0,2%), da es sonst negative Auswirkungen auf den Körper verursacht.
Wasserfluorisierung
Sehr ähnlich wie mit Zahnpasten, Fluoridsalze wurden zu Trinkwasserquellen hinzugefügt, um das Aussehen von Karies bei denen zu bekämpfen, die es trinken. Die Konzentration muss immer noch viel niedriger sein (0,7 ppm). Diese Praxis ist jedoch normalerweise misstrauisch und kontrovers.
Oxidationsmittel
Das Gas f2 Es verhält sich wie ein sehr starkes Oxidationsmittel. Dies lässt viele Verbindungen mehr anordnen als Sauerstoff und eine Wärmequelle ausgesetzt. Deshalb wurde es in Raketentreibstoffmischungen verwendet, in denen sie sogar Ozon ersetzen können.
Polymere
Bei vielen Verwendungen sind Fluoridbeiträge nicht auf f zurückzuführen2 oder f-, aber direkt zu seinen elektronegativen Atomen, die Teil einer organischen Verbindung bilden. Daher im Wesentlichen einer C-F-Verbindung.
Abhängig von der Struktur sind Polymere oder Fasern mit C-F-Bindungen normalerweise hydrophob, sodass sie nicht nass werden oder dem Angriff von Fluorhorsäure widerstehen. Oder noch besser, sie können ausgezeichnete elektrische Isolatoren und nützliche Materialien sein, mit denen Objekte wie Rohre und Fugen hergestellt werden. Teflon und Navion sind Beispiele für diese fluorierten Polymere.
Apotheker
Die Reaktivität von Fluorid wird als Verwendung für die Synthese mehrerer Fluorin-, organischer oder anorganischer Verbindungen bezeichnet. Ersetzen Sie in organischen, insbesondere in pharmakologischen Wirkungen eines ihrer Heteroátomos durch Atome F zunehmend (positiv oder negativ) seine Wirkung auf ihr biologisches Ziel.
Aus diesem Grund steht in der pharmazeutischen Industrie die Modifikation einiger Arzneimittel immer auf der Tabelle durch Hinzufügen von Fluoratomen.
Sehr ähnlich tritt bei Herbiziden und Fungiziden auf. Das Fluor in ihnen kann ihre Wirkung und Wirksamkeit bei Insekten und Pilzen erhöhen.
Glasgravur
Fluorhorsäure wurde aufgrund ihrer Aggressivität mit Glas und Keramik verwendet, um dünne und empfindliche Teile dieser Materialien aufzunehmen. Normalerweise für die Herstellung von Computernmikrokomponenten oder für elektrische Glühbirnen bestimmt.
Urananreicherung
Eine der relevantesten Verwendungen von elementarem Fluorid ist die Anreicherung von Uran als 235ODER. Zu diesem Zweck lösen sich Uranmineralien in Fluorhorsäure und produzieren UF4. Dieses anorganische Fluorid reagiert dann mit dem f2, Sich in UF verwandeln6 (235PUH6 Und 238PUH6).
Anschließend und durch eine Gaszentrifugation die 235PUH6 Es trennt sich von 238PUH6 und dann oxidiert und als Kernbrennstoff gespeichert.
Verweise
- Shiver & Atkins. (2008). Anorganische Chemie. (Vierte Edition). Mc Graw Hill.
- Krämer Katrina. (2019). Die Struktur des gefrorenen Fluors wurde nach 50 Jahren wiederholt. Die Royal Society of Chemistry. Erholt von: Chemistryworld.com
- Wikipedia. (2019). Fluor. Abgerufen von: in.Wikipedia.Org
- Nationales Zentrum für Biotechnologie Information. (2019). Fluor. Pubchem -Datenbank. CID = 24524. Erholt von: Pubchem.NCBI.NLM.NIH.Regierung
- DR. Doug Stewart. (2019). Fluorelement -Fakten. Chemicool. Erholt von: Chemicoolool.com
- Batul Nafisa Baxamusa. (21. Februar 2018). Die überraschend häufigen Verwendungen des hochreaktiven Fluors. Erholt von: Sciencestruck.com
- Paola Opazo Sáez. (4. Februar 2019). Fluorid in Zahnpasta: Ist es gut oder schlecht für die Gesundheit? Erholt von: Nacionfarma.com
- Karl Christen & Stefan Schneider. (8. Mai 2019). Fluor: Chemisches Element. Encyclopædia Britannica. Erholt von: Britannica.com
- Lentech b.V. (2019). Periodentabelle: Sauerstoff. Erholt von: lentech.com
- Gagnon Steve. (S.F.). Das Element Fluor. Jefferson Lab. Erholt von: Bildung.JLAB.Org
- Das Team der American Cancer Society Medical und Redaktion inhalt. (28. Juli 2015). Wasserfluoridierung und Krebsrisiko. Erholt von: Krebs.Org
- « Exakte wissenschaftliche Merkmale, was studieren Sie, Beispiele
- Keine Metallgeschichte, Eigenschaften, Gruppen, verwendet »

