Calciumfluorid (CAF2) -Struktur, Eigenschaften, verwendet

- 1206
- 342
- Ibrahim Steuk
Er Kalziumfluorid Es ist ein anorganischer Feststoff, der durch ein Calciumatom (CA) und zwei Fluoratome (F) gebildet wird. Seine chemische Formel ist CAF2 Und es ist ein kristalliner grau -weißer Feststoff.
In der Natur ist es im Fluoriterz oder im Spitzfluor vorhanden. Es existiert natürlich in Knochen und Zähnen. Fluorit -Mineral ist die Hauptquelle, mit der andere Fluorverbindungen erhalten werden.
 CAF Calciumfluorid2 solide. W: Benutzer: Walkerma im Juni 2005. Quelle: Wikimedia Commons.
CAF Calciumfluorid2 solide. W: Benutzer: Walkerma im Juni 2005. Quelle: Wikimedia Commons. Zusätzlich der Kaffee2 Es wird zur Kariesprävention in den Zähnen verwendet, so dass es zu Materialien hinzugefügt wird, die von Zahnärzten verwendet werden, um sie zu heilen. Tatsächlich wird auch Kalziumfluorid zu Trinkwasser (Wasser, das betrunken werden) zugesetzt.
CAF2 Es wird in großen Kristallen in optischen Geräten und Kameras verwendet. Es wird auch in kleinen Geräten verwendet, die erkennen, wie viel eine Person Radioaktivität ausgesetzt war.
[TOC]
Struktur
CAF Calciumfluorid2 Es ist eine ionische Verbindung, die durch ein CA -Kalziumkation gebildet wird2+ und zwei Fluorid -Fanien-. Einige Informationsquellen zeigen jedoch, dass ihre Links einen bestimmten kovalenten Charakter haben.
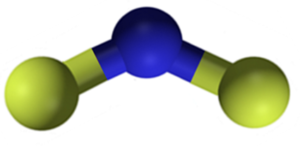 CAF Calciumfluoridstruktur2. Blau: Kalzium; Gelber Fluor. Claudio Pistilli [CC BY-SA 4.0 (https: // creativecommons.Org/lizenzen/by-sa/4.0)]]. Quelle: Wikimedia Commons.
CAF Calciumfluoridstruktur2. Blau: Kalzium; Gelber Fluor. Claudio Pistilli [CC BY-SA 4.0 (https: // creativecommons.Org/lizenzen/by-sa/4.0)]]. Quelle: Wikimedia Commons. Nomenklatur
Kalziumfluorid
Eigenschaften
Körperlicher Status
Färben fest bis grauweiß mit kubischen kristallinen Struktur.
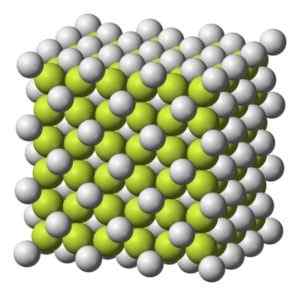 Kubische kristalline Struktur von Kaffee2. Benjah-BMM27 [Public Domain]. Quelle: Wikimedia Commons.
Kubische kristalline Struktur von Kaffee2. Benjah-BMM27 [Public Domain]. Quelle: Wikimedia Commons. Molekulargewicht
78,07 g/mol
Schmelzpunkt
1418 ºC
Siedepunkt
2533 ºC
Dichte
3,18 g/cm3 bei 20 ° C.
Brechungsindex
1.4328
Löslichkeit
Es ist in Wasser bei 20 ° C unlöslich. Fast unlöslich bei 25 ° C: 0,002 g/100 ml Wasser. Leicht saure löslich.
Chemische Eigenschaften
Die oxidierenden oder reduzierenden Eigenschaften sind sehr schwach, diese Reaktionen können jedoch auftreten. Obwohl normalerweise in sehr wenigen Fällen.
Es ist in organischen chemischen Verbindungen und vielen Säuren inert, einschließlich HF -Fluorhorsäure. Es löst sich langsam in Salpetersäure auf3.
Kann Ihnen dienen: Millikan Experiment: Verfahren, Erklärung, WichtigkeitEs ist nicht brennbar. Reagiert nicht schnell mit Luft oder Wasser.
Aufgrund seiner geringen Affinität zu Wasser, obwohl es einem hohen Prozentsatz der Feuchtigkeit ausgesetzt ist, wirkt es sich nicht selbst für einen Monat bei normaler Raumtemperatur nicht aus.
In Gegenwart von Feuchtigkeit werden die Wände ihrer Kristalle bei Temperaturen über 600 ° C langsam gelöst. In trockenen Umgebungen kann es bis zu 1000 ° C ohne merklich betroffene Einsatz verwendet werden.
Präsenz in der Natur
CAF Calciumfluorid2 Es ist natürlich in Fluoriterz oder Spritzfluorid vorhanden.
Obwohl der Kaffee2 Pure ist farblos, Fluoritmineral wird oft durch das Vorhandensein von Elektronen gefärbt, die in den "Löchern" der kristallinen Struktur gefangen sind.
Dieses Mineral wird für seine glasige Helligkeit und Vielfalt von Farben sehr geschätzt (lila, blau, grün, gelb, farblos, braun, rosa, schwarz und rotes Orange). Es soll "das farbigste Mineral der Welt" sein ".
 Fluorit einer Mine in Frankreich. Toulouse Muséum [CC BY-SA 3.0 (https: // creativecommons.Org/lizenzen/by-sa/3.0)]]. Quelle: Wikimedia Commons.
Fluorit einer Mine in Frankreich. Toulouse Muséum [CC BY-SA 3.0 (https: // creativecommons.Org/lizenzen/by-sa/3.0)]]. Quelle: Wikimedia Commons. Fluorit (blaue Kristalle) des natürlichen Museums von Mailand. Giovanni Dall'orto [CC BY-SA 2.5 Es (https: // creativeCommons.Org/lizenzen/by-sa/2.5/it/Tat.In)]. Quelle: Wikimedia Commons.
Fluorit (blaue Kristalle) des natürlichen Museums von Mailand. Giovanni Dall'orto [CC BY-SA 2.5 Es (https: // creativeCommons.Org/lizenzen/by-sa/2.5/it/Tat.In)]. Quelle: Wikimedia Commons. Fluorit einer Mine in England. Didier Descuens [CC BY-SA 4.0 (https: // creativecommons.Org/lizenzen/by-sa/4.0)]]. Quelle: Wikimedia Commons.
Fluorit einer Mine in England. Didier Descuens [CC BY-SA 4.0 (https: // creativecommons.Org/lizenzen/by-sa/4.0)]]. Quelle: Wikimedia Commons. Fluorit einer Mine in Frankreich. Didier Descuens [CC BY-SA 3.0 (https: // creativecommons.Org/lizenzen/by-sa/3.0)]]. Quelle: Wikimedia Commons.
Fluorit einer Mine in Frankreich. Didier Descuens [CC BY-SA 3.0 (https: // creativecommons.Org/lizenzen/by-sa/3.0)]]. Quelle: Wikimedia Commons.
 Fluorit einer Mine in den USA. Autor: Oliveira Jurema. Quelle: Wikimedia Commons.
Fluorit einer Mine in den USA. Autor: Oliveira Jurema. Quelle: Wikimedia Commons. Calciumfluorid wird auch in Knochen in Mengen zwischen 0,2 und 0,65%und auch im Zahnschmelz der Zähne in 0,33-0,59%gefunden.
Anwendungen
- Bei der Erlangung von Fluoridverbindungen
Fluorita CAF2 Es ist die grundlegende oder mehrheitliche Quelle von Fluorid weltweit. Es ist das Rohstoff, um fast alle Fluorverbindungen vorzubereiten.
Das Wichtigste davon ist HF Fluorhorsäure, aus der die anderen fließenden Verbindungen hergestellt werden. Das Fluorid -Ion f- Es wird aus dem Mineral durch Reaktion davon mit konzentrierter Schwefelsäure H freigesetzt2SW4:
Kann Ihnen dienen: IsomeriaCAF2 (fest) + h2SW4 (Flüssigkeit) → Fall4 (fest) + 2 HF (Gas)
- In der Zähnepflege
CAF Calciumfluorid2 Es ist ein Agent für die Prävention von Karies. Es wird verwendet, um trinkbares Wasser (Wasser, das trinken) mit diesem Ziel zu fluorisieren.
Zusätzlich die niedrigen Fluoridkonzentrationen f f- (in der Größenordnung von 0,1 Teilen pro Million), die in dentifrischen Pasten und Mundwasser verwendet werden, haben gezeigt.
 Calciumfluorid hilft bei der Kariesprävention. Autor: Annalize Batista. Quelle: Pixabay.
Calciumfluorid hilft bei der Kariesprävention. Autor: Annalize Batista. Quelle: Pixabay. CAF -Nanopartikel2 effektiver
Obwohl Fluoride in Zahnpasten und Spülen verwendet werden, führt die geringe Calciumkonzentration (CA) im Speichel dazu2 in den Zähnen auf die effektivste Weise möglich.
Deshalb wurde eine Möglichkeit, Kaffeestaub zu bekommen2 als Nanopartikel.
Dazu wird ein Trockner von Rocío (von Englisch Sprühtrockner) Wobei zwei Lösungen (eines von CA (OH) Calciumhydroxid2 und eines von Ammoniumfluorid NH4F) Sie mischen sich, während sie in eine Kamera mit heißem Luftstrom besprüht werden.
Dann tritt die folgende Reaktion auf:
CA (OH)2 + NH4F → CAF2 (fest) + nh4Oh
Der NH4Oh volatilisiert als NH3 und h2O und die CAF -Nanopartikel bleiben bestehen2.
Diese haben eine hohe Reaktivität und eine größere Löslichkeit, was sie zur Seineralisierung von Zähnen und als Antikarien wirksamer macht.
- In Objektiv für optische Ausrüstung
Calciumfluorid wird verwendet, um optische Elemente wie Prismen und Spektrophotometer von Infrarot und Ultraviolettlicht (UV) aufzubauen.
Diese Geräte ermöglichen das Messen der Lichtmenge.
CAF2 In diesen Regionen des Lichtspektrums ist es transparent, hat einen extrem niedrigen Brechungsindex und ermöglicht eine effizientere Auflösung als die von NaCl im Intervall 1500-4000 cm-1.
Kann Ihnen dienen: ParamagnetismusDank seiner chemischen Stabilität kann die optischen Elemente des CAF nachteilige Bedingungen unterstützen2 Sie werden nicht angegriffen. Es hat auch eine hohe Härte.
In Kameras
Einige Kamerahersteller verwenden Kaffeeobjektive2 Künstliche Kristallisiert, um die Lichtdispersion zu verringern und eine hervorragende Korrektur der Farbenverzerrung zu erzielen.
 Einige Kameras haben CAF -Kalziumfluoridlinsen2 Farbenverzerrungen reduzieren. Bill Ebbesen [CC von 3.0 (https: // creativecommons.Org/lizenzen/bis/3.0)]]. Quelle: Wikimedia Commons.
Einige Kameras haben CAF -Kalziumfluoridlinsen2 Farbenverzerrungen reduzieren. Bill Ebbesen [CC von 3.0 (https: // creativecommons.Org/lizenzen/bis/3.0)]]. Quelle: Wikimedia Commons. - In der metallurgischen Industrie
CAF2 Es wird als Gründungsmittel in der metallurgischen Industrie verwendet, da es eine Quelle für in Wasser unlösliche Kalziumanwendungen ist und daher in sauerstoffempfindlichen Anwendungen wirksam ist.
Es wird verwendet, um Eisen und Stahl zu schmelzen und zu verarbeiten. Dies basiert darauf.
- In Radioaktivitätsdetektoren oder gefährlicher Strahlung
CAF2 Es ist ein Thermolumineszenzmaterial. Dies bedeutet, dass es Strahlung in den Elektronen seiner kristallinen Struktur absorbieren kann und dann, wenn es erhitzt wird, um sie in Form von Licht freizusetzen.
Dieses emittierte Licht kann durch ein elektrisches Signal gemessen werden. Dieses Signal ist proportional zur Menge an Strahlung, die das Material erhalten hat. Bedeutet, dass je größer die Strahlungsmenge ist, desto größer ist die Lichtmenge, die später beim Erhitzen emittiert wird.
Deshalb der CAF2 Es wird in den sogenannten persönlichen zweiimetern verwendet, die von Menschen verwendet werden, die einer gefährlichen Strahlung ausgesetzt sind, und Sie möchten wissen, wie viel Strahlung sie in einem bestimmten Zeitraum erhalten haben.
- Andere Verwendungen
- Es wird als Katalysator bei chemischen Reaktionen von Dehydration und Dehydrierung für die Synthese organischer Verbindungen verwendet.
- Es wird in alkalischen Schweißelektroden verwendet. Ein stärkeres Schweißen wird erhalten als mit Säurelektroden. Diese Elektroden sind nützlich bei der Herstellung von Schiffen und Hochdruckstahlbehältern.
- Als Lebensmittelergänzung in extrem niedrigen Mengen (ppm oder Teile pro Million).
 Mannschweißen. Elektroden mit Calciumfluoridkaffee2 Sie bilden stärkere Schweißnähte. William m. Platte Jr. [Public Domain]. Quelle: Wikimedia Commons.
Mannschweißen. Elektroden mit Calciumfluoridkaffee2 Sie bilden stärkere Schweißnähte. William m. Platte Jr. [Public Domain]. Quelle: Wikimedia Commons. Verweise
- Pirmradian, m. und Hooshmand, t. (2019). Remineralisierung und antibakterielle Fähigkeiten von Zahnnanokompositen auf Harzbasis auf Harzbasis. Synthese und Charakterisierung von Calciumfluorid (CAF2). In Anwendungen von Nanokompositmaterialien in der Zahnmedizin. Von Scientedirect erholt.com.
- ODER.S. Nationalbibliothek für Medizin. (2019). Fluorid Calcium. Aus Pubchem geborgen.NCBI.NLM.NIH.Regierung.
- Weman, k. (2012). MMA -Schweißen (Metall -ARC Manual) mit beschichteten Elektroden. In Schweißprozessen Handbuch (zweite Ausgabe). Von Scientedirect erholt.com.
- Hanning, m. und Hanning, c. (2013). Nanobiomaterialien in der vorbeugenden Zahnmedizin. Nanie -Fluorid Calcium. In Nanobiomaterialien in der klinischen Zahnheilkunde. Von Scientedirect erholt.com.
- Ropp, r.C. (2013). Gruppe 17 (H, F, Cl, Br, I) Alkalische Erdverbindungen. Fluorid Calcium. In Enzyklopädie der alkalischen Erdverbindungen. Von Scientedirect erholt.com.
- Baumwolle, f. Albert und Wilkinson, Geoffrey. (1980). Fortgeschrittene anorganische Chemie. Vierte Edition. John Wiley & Söhne.
- Valkovic, v. (2000). Messungen der Radioaktivität. In der Radioaktivität in der Umwelt. Themolumineszierende Detektoren (TLDs). Von Scientedirect erholt.com.
- « Nitruro de Boro (BN) Struktur, Eigenschaften, erhalten, verwendet, verwendet
- Siliziumoxidstruktur (SiO2), Eigenschaften, Verwendungen, erhalten »

