Lithiumfluoridstruktur, Eigenschaften, erhalten, verwendet, verwendet

- 2634
- 336
- Nick Laurén
Er Lithiumfluorid Es ist ein anorganischer Feststoff, dessen chemische Formel das Leben ist. Wird von Li -Ionen gebildet+ und f- die durch eine ionische Bindung vereint sind. Es kommt in kleinen Mengen in mehreren Mineralien vor, insbesondere in Silikaten wie Lepidolith, Meerwasser und in vielen Mineralbrunnen.
Aufgrund seiner Transparenz in einem weiten Bereich von Wellenlängen, vom Infrarotspektrum (IR) bis zum UV -Ultraviolett, bis zum sichtbaren.
 Lepidolith, Mineral, das kleine Mengen an Lifal -Fluorid enthält. Rob Lavinsky, Irocks.com-c-by-sa-3.0 [CC BY-SA 3.0 (https: // creativecommons.Org/lizenzen/by-sa/3.0)]]. Quelle: Wikimedia Commons.
Lepidolith, Mineral, das kleine Mengen an Lifal -Fluorid enthält. Rob Lavinsky, Irocks.com-c-by-sa-3.0 [CC BY-SA 3.0 (https: // creativecommons.Org/lizenzen/by-sa/3.0)]]. Quelle: Wikimedia Commons. Es wurde auch auf Geräten verwendet. Darüber hinaus wird es als Material zum Schmelzen von Aluminium oder zum Herstellen von Gläern oder Gläsergläser und Keramik verwendet.
Es dient als Material, um Lithium -Ion -Batterienkomponenten abzudecken und den anfänglichen Verlust der Belastung dieser zu verhindern.
[TOC]
Struktur
Lithiumfluorid ist eine ionische Verbindung, dh durch die Vereinigung des Li -Kationen+ und der Anion f-. Die Kraft, die sie zusammenhält, ist elektrostatisch und wird als ionische Bindung bezeichnet.
Wenn das Lithium kombiniert wird, gibt er Fluorid ein Elektron, das beide stabiler als der anfängliche Weg ist, wie unten erläutert.
Das Lithiumelement hat die folgende elektronische Konfiguration: [er] 1s2 2s1 Und wenn ein Elektron angibt, ist die elektronische Struktur so: [er] 1s2 das ist viel stabiler.
Das Fluorelement, dessen elektronische Konfiguration lautet: [NE] 1s2 2s2 2 p5, Durch die Akzeptanz des Elektrons ist die Form [NE] 1s2 2s2 2 p6, stabiler.
Nomenklatur
- Lithiumfluorid
- Fluorolitio
Kann Ihnen dienen: nicht -metallische Oxide- Lithiummonfluorid
Eigenschaften
Körperlicher Status
Weißer Feststoff, der in Kubikstruktur wie Natriumchlorid -NaCl kristallisiert.
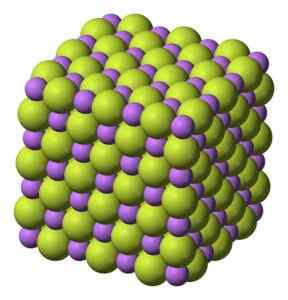 Kubikstruktur von Lifium -Lithium -Fluoridkristallen. Benjah-BMM27 [Public Domain]. Quelle: Wikimedia Commons.
Kubikstruktur von Lifium -Lithium -Fluoridkristallen. Benjah-BMM27 [Public Domain]. Quelle: Wikimedia Commons. Molekulargewicht
26 g/mol
Schmelzpunkt
848,2 ºC
Siedepunkt
1673 ºC, obwohl es bei 1100-1200 ºC flüchtig ist
Dichte
2.640 g/cm3
Brechungsindex
1.3915
Löslichkeit
Wenig löslich im Wasser: 0,27 g/100 g Wasser bei 18 ºC; 0,134 g/100 g bei 25 ºC. Löslich in saurem Medium. Unlöslich in Alkohol.
Andere Eigenschaften
Seine Dämpfe haben dimische Arten (LIF)2 und trimer (LIF)3. Mit HF Fluorhorhorsäure bilden lihf lithium2; Mit Lithiumhydroxid bildet es ein doppeltes Lebenssalz.Lioh.
Erhalten und Ort
LIF -Lithiumfluorid kann durch Reaktion zwischen HF -Fluorhorsäure und Lioh -Lithiumhydroxid oder Lithium -Lithium -Carbonat erhalten werden2CO3.
Es ist jedoch in kleinen Mengen in bestimmten Mineralien wie Lepidolith und Meerwasser vorhanden.
 Lithiumfluorid findet sich in kleinen Mengen im Meerwasser. Adeeb Atwan [CC von 3.0 (https: // creativecommons.Org/lizenzen/bis/3.0)]]. Quelle: Wikimedia Commons.
Lithiumfluorid findet sich in kleinen Mengen im Meerwasser. Adeeb Atwan [CC von 3.0 (https: // creativecommons.Org/lizenzen/bis/3.0)]]. Quelle: Wikimedia Commons. Anwendungen
In optischen Anwendungen
Der LIF wird in Form von kompakten Kristallen in Infrarot -Spektrophotometern (IR) aufgrund der hervorragenden Dispersion im Wellenlängenintervall zwischen 4000 und 1600 cm verwendet-1.
LIF -LIF -Kristalle werden aus gesättigten Lösungen aus diesem Salz erhalten. Es kann natürliche Fluoritkristalle in verschiedenen Arten von optischen Geräten ersetzen.
Große und reine Kristalle werden in optischen Systemen für ultraviolettes Licht (UV), sichtbar und IR- und Röntgenmonochromatoren (0,03-0,38 nm) verwendet.
 Lebensleben Fluoruro Kristall in einem Becher. V1ADIS1AV [Public Domain]. Quelle: Wikimedia Commons.
Lebensleben Fluoruro Kristall in einem Becher. V1ADIS1AV [Public Domain]. Quelle: Wikimedia Commons. Es wird auch als optisches Beschichtungsmaterial für die UV -Region aufgrund seines breiten optischen Bandes verwendet, größer als das anderer Metallfluoride.
Es kann Ihnen dienen: Alkalinotaler -MetalleSeine Transparenz im entfernten UV (90-200 nm) macht es ideal als Schutzbeschichtung in Aluminiumspiegeln (Al). LIF/AL -Spiegel werden in optischen Teleskopsystemen für Raumanwendungen verwendet.
Diese Beschichtungen werden durch physikalische Ablagerung von Dampf- und Schichtabscheidung auf atomarer Ebene erreicht.
Bei ionisierenden oder gefährlichen Strahlungsdetektoren
Lithiumfluorid wurde bei Thermolumineszenzdetektoren für Photonen, Neutronen- und β (Beta) -Anstrahlung häufig verwendet.
Thermolumineszenzdetektoren halten die Strahlungsenergie, wenn sie dies ausgesetzt ist. Anschließend beim Erhitzen füllen Sie die in leichten Form gespeicherte Energie frei.
Für diese Anwendung wird der LIF im Allgemeinen mit Magnesiumverunreinigungen (Mg) und Titan (TI) datiert. Diese Verunreinigungen erzeugen bestimmte Energieniveaus, die als Löcher wirken, in denen die durch Strahlung freigesetzten Elektronen eingeschlossen sind. Wenn das Material dann erhitzt wurde, kehren diese Elektronen zu ihrem ursprünglichen Energiezustand zurück, der Licht ausgibt.
Die Intensität des emittierten Lichts hängt direkt von der vom Material absorbierten Energie ab.
Thermolumineszenzdetektoren von LIF wurden erfolgreich getestet, um komplexe Strahlungsfelder wie die im großen Hadron Collider oder LHC vorhandenen (für das Akronym für Englisch) zu messen Large Hadron Collider), befindet sich in der Europäischen Organisation für Atomforschung, bekannt als CERN (für sein Akronym für Französisch Conseil Européen gießen den Wiederaufbau Nucleaire ein).
Strahlung in den Erfahrungen, die in diesem Forschungszentrum durchgeführt werden.
Als Material, um die Lithium -Batterie -Kathode voranzutreiben
Das LIF wurde erfolgreich in Form von Nanokompositen mit Kobalt (CO) und Eisen (Glaube) als Vorrangsmaterial (Übersetzung von Englisch Vorbereitungen) des Lithium -Ion -Batteriekathodenmaterials.
Kann Ihnen dienen: EthyletherWährend des ersten Lastzyklus oder der Bildungsstufe einer Lithiumionenbatterie wird der organische Elektrolyt zu einer festen Phase auf der Oberfläche der Anode abgebaut.
Dieser Prozess verbraucht Lithium der Kathode und reduziert die Energie zwischen 5 und 20% der Gesamtkapazität der Lithiumionenbatterie.
Aus diesem Grund wurde die elektrochemische Vorab der Kathode untersucht, die eine elektrochemische Extraktion des Lithiums der Nanokomponzierung erzeugt, die als Lithiumspender fungiert und somit den Verbrauch von Lithium der Kathode vermeidet.
Nanokompositen LIF/CO und LIF/Fe haben eine hohe Kapazität, Lithium an die Kathode zu spenden, leicht zu synthetisieren, stabil unter Umwelt- und Batterieverarbeitungsbedingungen.
 Litium-Ionen-Batterie. Autor: MR.ちゅら さん. Lithium_battery * Fotografie Tag, August 2005 * Fotografie Aney. Quelle: Wikimedia Commons.
Litium-Ionen-Batterie. Autor: MR.ちゅら さん. Lithium_battery * Fotografie Tag, August 2005 * Fotografie Aney. Quelle: Wikimedia Commons. In mehreren Verwendungen
Lithiumfluorid wird als Schweißmesser, insbesondere Aluminium, und in Schweißstangenbeschichtungen verwendet. Es wird auch in Aluminium -Reduktionszellen verwendet.
Es wird häufig bei der Herstellung von Glas (wie denen der Linsen) verwendet, in denen der Expansionskoeffizient abnimmt. Es wird auch in der Herstellung von Keramik verwendet. Darüber hinaus wird es bei der Herstellung von Emaille und Glaskörperlack verwendet.
Das LIF ist eine Kraftstoffkomponente für Raketen und Brennstoffe für bestimmte Arten von Reaktoren.
LIF wird auch in leichten Dioden oder Photovoltaikkomponenten für die Injektion von Elektronen in Innenschichten verwendet.
Verweise
- Baumwolle, f. Albert und Wilkinson, Geoffrey. (1980). Fortgeschrittene anorganische Chemie. Vierte Edition. John Wiley & Söhne.
- ODER.S. Nationalbibliothek für Medizin. (2019). Fluorid Lithium. Erholt von: Pubchem.NCBI.NLM.NIH.Regierung.
- Obryk, b. et al. (2008). Die Reaktion verschiedener Arten von TL-Lithium-Fluorid-Detektoren auf hochanergische gemischte Strahlungsfelder. Strahlungsmessungen 43 (2008) 1144-1148. Von Scientedirect erholt.com.
- Sonne und. et al. (2016). In der sitz -chemischen Synthese von Lithiumfluorid/Metall -Nanokomposit für Vorlagen von Kathoden mit hoher Kapazität. Nano Letters 2016, 16, 2, 1497-1501. Aus Pubs geborgen.ACS.Org.
- Hennessy, J. und Nikzad, s. (2018). Atomschichtabscheidung von lithiumfluorid optischen Beschichtungen für das Ultraviolett. Inorganics 2018, 6, 46. MDPI erholt sich.com.
- « 10 wissenschaftliche Experimente für physikalische Sekundär, Chemie, Biologie
- Methylmalonsäurestruktur, Eigenschaften, Synthese, verwendet »

