Magnesiumfluoridstruktur, Eigenschaften, Synthese, verwendet
- 3277
- 426
- Lewis Holzner
Er Magnesiumfluorid Es ist ein farbloses anorganisches Salz, dessen chemische Formel MGF₂ ist. Es ist in der Natur als Sealíta Mineral gefunden. Es hat einen sehr hohen Fusionspunkt und ist im Wasser sehr wenig löslich. Es ist relativ inert, da beispielsweise seine Reaktion auf Schwefelsäure langsam und unvollständig ist und Hydrolyse mit Fluorhorsäure (HF) bis 750 ° C widersteht.
Es ist eine Verbindung, die von hoher Energiestrahlung wenig beeinflusst wird. Darüber hinaus weist es einen niedrigen Brechungsindex, eine hohe Korrosionsbeständigkeit, eine gute thermische Stabilität, eine signifikante Härte und die hervorragenden Eigenschaften für sichtbares Licht, UV (Ultraviolett) und IR (Infrarot) auf.

Diese Eigenschaften haben eine hervorragende Leistung im optischen Bereich und machen es außerdem zu einem nützlichen Material wie Katalysatorunterstützung, Beschichtungselement, Anti -Reflex -Objektiven und Fenstern für die Infrarotübertragung, unter anderem.
[TOC]
Struktur
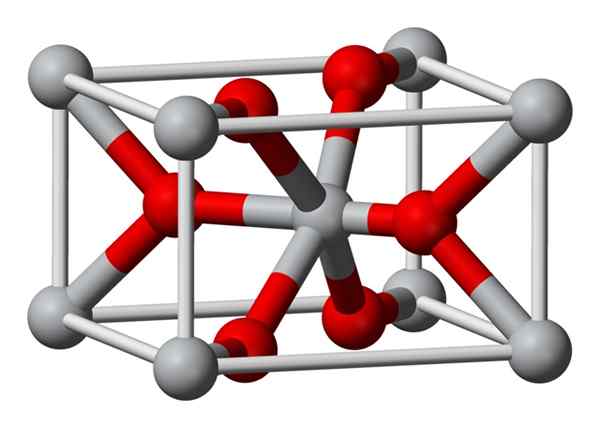
Die chemisch hergestellte kristalline Struktur von Magnesiumfluorid ist der gleiche Typ wie der des natürlichen Minerals von Sellaíta. Kristallisiert in der Dipiramid -Klasse des tetragonalen Systems.
Magnesiumionen (Mg2+) befinden sich in einem tetragonalzentrierten raumzentrierten, während Fluoridionen (F-) in derselben Ebene ihrer Nachbarn Mg2+ gefunden und damit verbunden sind, die zu jedem Zeitpunkt mit jeweils zusammen gruppiert sind. Der Abstand zwischen den Mg2+ und den F-Ionen beträgt 2,07 Å (Angstrome) (2,07 × 10-10 m).
Seine kristalline Koordination beträgt 6: 3. Dies bedeutet, dass jedes Mg2+ -Ion von 6 Ionen f-umgeben ist und jedes Ion f- wiederum von 3 mg2+ 5 Ionen umgeben ist.
Die Struktur ist der des Rutilo -Minerals sehr ähnlich, der natürlichen Form von Titandioxid (TiO2), mit denen sie mehrere kristografische Eigenschaften aufweist.
Während der Erfassung fällt Magnesiumfluorid nicht in Form von amorphem Feststoff aus, da mg2+ und f -ionen nicht dazu neigen.
Eigenschaften
Es ist interessant zu betonen. Dies ist eine optische Eigenschaft, die es Ihnen ermöglicht, einen Strahl von einfallendem Licht in zwei getrennte Strahlen zu entfalten, die sich an verschiedenen Wavelves und Wellenlängen ausbreiten.
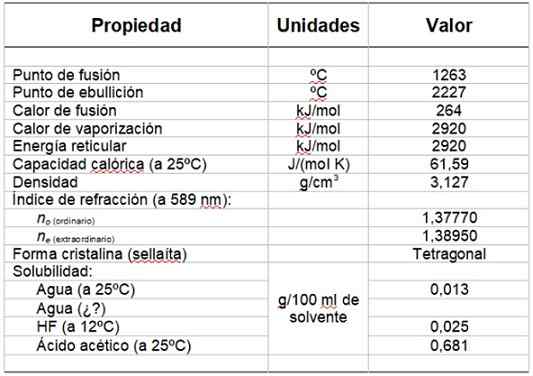
Kann Ihnen dienen: HydroxylgruppeTabelle 1 zeigt einige seiner Eigenschaften.
Tabelle 1. Physikalische und chemische Eigenschaften von Magnesiumfluorid.
Synthese und Vorbereitung
Es kann auf verschiedene Arten vorbereitet werden, unter denen Folgendes erwähnt werden kann:
1 Wege die Reaktion zwischen Magnesiumoxid (MGO) oder Magnesiumcarbonat (Mgco3) mit Fluoridsäure (HF) 2:
Mgo + 2 Hf Mgf2 + H2O
MGCO3 + 2 HF MGF2 + CO2 + H2O
2-für-Reaktion zwischen Magnesiumcarbonat und Ammoniumbifluoruro (NH4HF2), beide im Festkörper, bei einer Temperatur zwischen 150 und 400 ° C2:
150-400ºC
Mgco3 + NH4HF2 MGF2 + NH3 + CO2 + H2O
3-kalento Eine wässrige Lösung von Magnesiumcarbonat und Ammoniumfluorid (NH4F) in Gegenwart von Ammoniumhydroxid (NH4OH) bei 60 ° C 2:
60ºC, NH4OH
MGCO3 + 3 NH4F NH4MGF3 + (NH4) 2CO3
Der Niederschlag von Ammonium und Magnesiumfluorid (NH4MGF3) wird dann 4 Stunden lang auf 620 ° C erhitzt, um Magnesiumfluorid zu erhalten:
620ºC
NH4MGF3 MGF2 + NH3 + HF
4-as Nebenprodukt der Erlangung von Beryllium (BE) und Uran (u). Das Fluorid des gewünschten Elements mit metallischem Magnesium wird in einem MGF2 2 -bedeckten Schmelztopf erhitzt:
BEF2 + mg sein + mgf2
5-Stunden-Reaktions-Magnesiumchlorid (mgcl2) mit Ammoniumfluorid (NH4F) in wässriger Lösung bei Raumtemperatur 3:
25ºC, H2O
Mgcl2 + 2 NH4F MGF2 + 2NH4CL
Da MGF2 -Vorbereitungsmethoden teuer sind, gibt es Versuche, es wirtschaftlicher zu erhalten, unter anderem die Methode zur Herstellung von Meerwasser aus Meerwasser.
Kann Ihnen dienen: Calciumhydrid (CAH2): Eigenschaften, Reaktivität und VerwendungDies ist gekennzeichnet, indem Meerwasser genügend Fluoridionen (F-) hinzugefügt wird, die eine reichlich vorhandene Konzentration von Magnesiumionen (Mg2+) aufweisen, wodurch der Ausfällung von MGF2 begünstigt wird.
Optische Magnesiumfluoridkristalle werden durch heißes Druck aus hoher Qualität mgf2 erhalten, die beispielsweise durch das NH4HF2 -Verfahren erhalten wurden.
Es gibt viele Techniken zur Herstellung von Magnesiumfluoridmaterial.
Anwendungen
Optik
MGF2 -Kristalle sind für optische Anwendungen geeignet, da sie von der UV -Region bis zum IR -Durchschnitt von 2,10 Region transparent sind.
Als inerter Film wird die Lichtübertragungseigenschaften von optischen und elektronischen Materialien verändert. Eine der Hauptanwendungen liegt in der VUV -Optik für die Weltraum -Explorationstechnologie.
Aufgrund seiner BirreFringcy -Eigenschaft ist dieses Material in der Polarisationsoptik nützlich, in den Ecimer -Laserfenstern und Prismen (Ultraviolett -Lasertyp, die in der Augenchirurgie verwendet werden).
Es ist zu beachten, dass das bei der Herstellung von optischen Materialien verwendete Magnesiumfluorid frei von Verunreinigungen oder Verbindungen sein muss, die Oxidquelle wie Wasser (H2O), Hydroxidionen (OH-), Carbonationen (CO3 = CO3 =) sind ), Sulfationen (SO4 =) und ähnliche 12.
Katalyse oder Beschleunigung von Reaktionen
Der MGF2 wurde erfolgreich als Katalysatorunterstützung für die Reaktion der Chlor -Eliminierung und die Zugabe von Wasserstoff im FALSOL (Chlorfluorkohlenwasserstoffen), gut bekannte Kältemittel und Aerosol -Treibmittel verwendet und für die Schädigung der Atmosphäre -Ozonschicht verantwortlich.
Die resultierenden Verbindungen, HFC (Hydrofluorkohlenwasserstoff) und HCFC (Hydrochlorofluorkohlenwasserstoff), präsentieren diese schädliche Wirkung nicht auf die Atmosphäre 5.
Es war auch als Unterstützung für Katalysatoren für die Hydrodesulfration (Schwefelelimination) organischer Verbindungen nützlich.
Kann Ihnen dienen: Chemisches Gleichgewicht: Erklärung, Faktoren, Typen, BeispieleAndere Verwendungen
Die von Graphit, Fluor und Mgf2 erzeugten Material.
Die von NAF und MGF2 gebildete Eutktik zeigt Energiespeichereigenschaften in latenter Wärme. Daher wurde sie für die Verwendung in Solarsystemen in Betracht gezogen.
Im Bereich der Biochemie wird Magnesiumfluorid zusammen mit anderen Metallfluoriden verwendet, um die Phosphoryltransferreaktionen in Enzymen zu hemmen.
Kürzlich wurden MGF2 -Nanopartikel erfolgreich als Arzneimittelplatzierungsvektoren in Krankenzellen zur Krebsbehandlung getestet.
Verweise
- Buckley, h.UND. und Vernon, w.S. (1925) xciv. Die Kristallstruktur von Magnesiumfluorid. Philosophical Magazine Series 6, 49: 293, 945-951.
- Kirk-Othmer (1994). Enzyklopädie der chemischen Technologie, Band 11, fünfte Ausgabe, John Wiley & Sons. ISBN 0-471-52680-0 (V).elf).
- Peng, Minhong; Cao, Weiping; und Lied, Jinhong. (2015). Vorbereitung von MGF2 Durchscheinender Keramik durch heißes Presssenssintern. Journal of Wuhan University of Technology-Mater: Sci. Ed. Vol. 30 Nr. 4.
- Непоконов, и.С. (2011). Fluorid -Magnesium. Quelle: eigene Arbeit.
- Wojciechowska, Maria; Zielinski, Michal; und Piettowski, Mariusz. (2003). MGF2 als nicht-konventionelle Katalysatorunterstützung. Journal of Fluor Chemistry, 120 (2003) 1-11.
- Korth Kristalle GmbH. (2019). Fluorid -Magnesium (MGF2). Konsultiert am 07.07.2019 in: Korth.von
- Sevonkaev, Igor und Matijevic, Egon. (2009). Bildung von Magnesiumfluoridpartikeln unterschiedlicher Morphologien. Langmuu 2009, 25 (18), 10534-10539.
- Непоконов, и.С. (2013). Fluorid -Magnesium. Quelle: eigene Arbeit.
- Tao Qin, Peng Zhang und Weiwei Qin. (2017). Eine neuartige Methode zur Synthese kostengünstiger Magnesiumfluoridkugeln aus Meerwasser. Ceramics International 43 (2017) 14481-14483.
- Ullmanns Enzyklopädie der Industriechemie (1996) Fünfte Ausgabe. Band A11. VCH Verlagsgellschaft MBH. New York. ISBN 0-89573-161-4.
- NASA (2013). Ingenieure, die den Hauptspiegel des Hubble Space Telescope 8109563 inspizieren. Quelle: Mix.MSFC.Topf.Regierung
- « Pictographic Writing Origin, Merkmale und Beispiele
- Eigenschaften und Beispiele für kommerzielle Transaktionen »

