Kaliumfluorid (KF)
- 4364
- 964
- Tizian Liebich
 Kaliumfluoridstruktur. Quelle: Benjah-BMM27, Wikimedia Commons
Kaliumfluoridstruktur. Quelle: Benjah-BMM27, Wikimedia Commons Was ist Kaliumfluorid?Er Kaliumfluorid Es ist ein anorganisches Halogenid, das aus einem Salz zwischen Metall und Halogen besteht. Seine chemische Formel ist KF, was für jedes Kation k bedeutet+ Es gibt eine f- des Gegenstücks. Die Wechselwirkungen sind elektrostatisch, und infolgedessen gibt es keine k-f-kovalenten Verbindungen.
Dieses Salz ist durch seine extreme Löslichkeit in Wasser gekennzeichnet, so dass es Hydrate bildet, Feuchtigkeit absorbiert und köstlich ist. Daher ist es sehr einfach, wässrige Lösungen davon vorzubereiten, die als Quelle für Fluoridanionen für all jene Synthese dienen, in denen es in eine Struktur einbezogen werden soll.
Der KI wird durch Reagieren von Kaliumcarbonat mit Fluorhorsäure produziert, wodurch Kaliumbifluorid (KHF) erzeugt wird2), was aufgrund einer thermischen Zersetzung zu Kaliumfluorid führt.
Kaliumfluoridstruktur
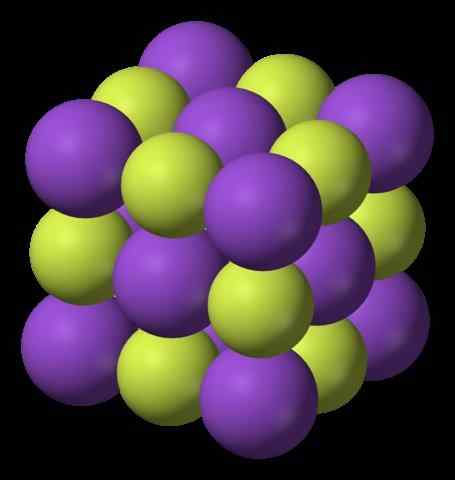
Das obere Bild zeigt die Struktur von Kaliumfluorid. Die lila Kugeln repräsentieren Kationen k+, Während die gelblich Kugeln Anionen repräsentieren F-.
Beachten Sie, dass die Anordnung kubisch ist und einer Gema -Salzstruktur entspricht, die dem von Natriumchlorid sehr ähnlich ist. Alle Kugeln sind von sechs Nachbarn umgeben, aus denen ein Oktaeder KF besteht6 oder fk6, das heißt, jeder k+ Es ist von sechs f umgeben-, Und das gleiche gilt umgekehrt.
Es wurde zuvor erwähnt, dass der KF hygroskopisch ist und daher die Luftfeuchtigkeit der Umwelt absorbiert. Somit würde die gezeigte Anordnung der wasserfreien Form (ohne Wasser) und nicht der Hydrate entsprechen, die so viel Wasser absorbieren, dass sogar löwizieren und "schmelzen" (Delagen).
Kann Ihnen dienen: Neon: Geschichte, Eigenschaften, Struktur, Risiken, verwendetHydrate
Die kristallinen Strukturen von Hydraten werden weniger einfach. Weil jetzt die Wassermoleküle direkt in die Anordnungen eingreifen und mit den K -Ionen interagieren+ und f-. Eines der stabilsten Hydrate ist der KF · 2H2O y kf · 4h2ENTWEDER.
In beiden Hydraten werden die neu erwähnten Oktaeder aufgrund der Wassermoleküle deformiert. Dies ist hauptsächlich auf Wasserstoffbrücken zwischen F zurückzuführen- und der h₂o (f--Hoh). Kristallographische Studien haben festgestellt, dass die beiden Ionen trotzdem die gleiche Anzahl von Nachbarn beibehalten.
Infolgedessen die ursprüngliche kubische Struktur für wasserfreies Kaliumfluorur.
Die Anhydros teilen das Delicuest.
Kaliumfluorideigenschaften
- Molekulargewicht: 58.097 g/mol.
- Physisches Aussehen (Farbe): Weiße kubische Kristalle oder zartes kristallines Staub.
- Geschmack: Akuter Salzgeschmack.
- Siedepunkt: 2.741 ° F bei 760 mmHg (1502 ° C). In einem flüssigen Zustand wird es ein Stromleiter, obwohl die Anionen f können- Arbeiten Sie nicht im gleichen Maße wie k zusammen+.
- Schmelzpunkt: 1.576 ° F; 858 ° C; 1131 K (KF Anhidro). Dies ist ein Hinweis auf seine starken ionischen Verbindungen.
- Löslichkeit: Löslich in HF, aber unlöslich in Alkohol. Dies zeigt, dass Wasserstoffbrücken zwischen Fluorid und Alkoholen f, f--Hor, sie bevorzugen den Solvationsprozess nicht gegen die Auflösung seines kristallinen Netzwerks.
- Wasserlöslichkeit: wasserfreies 92 g/100 ml (18 ° C); 102 g/100 ml (25 ° C); Dihydrared 349,3 g/100 ml (18 ° C). Das heißt, wenn der KF hydratisiert ist, wird es im Wasser löslicher.
- Dichte: 2,48 g/cm3.
- Dampfdruck: 100 kPa (750 mm Hg) bei 1.499 ° C.
- Zersetzung: Wenn er zur Zersetzung erhitzt wird, gibt er einen giftigen Rauch aus Kaliumoxid und Wasserstofffluorid aus.
- Korrosive Aktion: Eine wässrige Lösung korrodiert Glas und Porzellan.
- Flammpunkt: Es ist keine brennbare Substanz
- Experimenteller Brechungsindex (ηd): 1.363.
- Stabilität: stabil, wenn es vor Feuchtigkeit geschützt ist, da der Feststoff ansonsten aufgelöst wird. Mit starken Säuren und Basen unvereinbar.
Kaliumfluorid verwendet
- PH PH PLOD: Wässrige Kaliumfluoridlösungen werden in industriellen Anwendungen und Prozessen verwendet. Zum Beispiel ermöglichen KF -Lösungen den pH -Wert in den Herstellern, die in Textilverarbeitungs- und Wäschemöglichkeiten durchgeführt werden (sie sind einen Wert von 7).
- Fluorquelle: Kaliumfluorid ist nach Wasserstofffluorid die Hauptquelle für das Erhalten von Fluorid. Dieses Element wird in Kernkraftwerken und in der Herstellung von anorganischen und organischen Verbindungen verwendet, einige mit Verwendungszwecken wie deren Einbau in dentifriquen.
- Fluorkoarbone -Synthese: Kaliumfluorid kann zur Synthese von Fluorbone oder Fluorcarbid aus Chlorkohlenstoff unter Verwendung der Finkeisteinreaktion verwendet werden. In dieser Reaktion werden Ethylenglykol und Dimethylsulfoxid als Lösungsmittel verwendet.
- Fluorinierung: Wie eine Fluorquelle, in der sie in Wasser gelöst ist, können sie aus ihren Lösungen komplexe Fluoride synthetisieren, dh sie werden mit F eingebaut- Strukturen. Ein Beispiel ist in der folgenden chemischen Gleichung:
Mnbr2(ac) + 3kf (ac) => kmnf3(s) + 2kbr (ac)
- Dann schlägt KMNFs gemischtes Fluorid aus3. Somit konnte F hinzugefügt werden- Teil eines komplexen Metallsalzes sein. Neben Mangan können Fluoride anderer Metalle eilen: KCOF3, Kfef3, Messer3, KCF3 und Kznf3.
- Ebenso kann Fluorid kovalent in einen aromatischen Ring einbezogen werden, wobei die Organisation synthetisiert werden.
- Mehrere: KF wird als Zwischen- oder Rohstoffmaterial für die Synthese von Verbindungen verwendet, die hauptsächlich in Agrochemie- oder Pestizidprodukten verwendet werden.
- Außerdem wird es als Gründungsmittel von Weld verwendet.
Verweise
- Kaliumfluorid. Aus Chemicalbook wiederhergestellt.com.
- Kaliumfluorid. Aus Pubchem geborgen.NCBI.NLM.NIH.Regierung.

