Calciumphosphat (CA3 (PO4) 2)

- 4006
- 764
- Said Ganzmann
Er Calciumphosphat Es ist ein anorganisches und tertiäres Salz, dessen chemische Formel CA ist3(Po4)2. Die Formel legt fest, dass die Zusammensetzung dieses Salzes 3: 2 für Kalzium bzw. Phosphat beträgt. Dies ist direkt im unteren Bild zu sehen, in dem das Cation angezeigt wird2+ und die Anion Po43-. Für alle drei ca2+ Es gibt zwei Po43- mit ihnen interagieren.
Andererseits bezieht sich Calciumphosphat auf eine Reihe von Salzen, die je nach Ca/P -Verhältnis sowie den Grad der Hydratation und pH variieren. Tatsächlich gibt es viele Arten von Calciumphosphaten, die existieren und synthetisiert werden können. Nach dem Brief, der Nomenklatur, Calciumphosphat anspiel.
 Anteil und Ionen im Dreiradphosphat. Quelle: Richard-59 [CC BY-SA 3.0 (https: // creativecommons.Org/lizenzen/by-sa/3.0)] aus Wikimedia Commons
Anteil und Ionen im Dreiradphosphat. Quelle: Richard-59 [CC BY-SA 3.0 (https: // creativecommons.Org/lizenzen/by-sa/3.0)] aus Wikimedia Commons Alle Calciumphosphate, einschließlich ca3(Po4)2, Sie sind weiße Feststoffe mit leichten grauen Tönen. Sie können körnig, fein, kristallin sein und Partikelgrößen um die Mikrometer haben. Und sogar Nanopartikel dieser Phosphate wurden hergestellt, mit denen biokompatible Materialien für die Knochen ausgelegt sind.
Diese Biokompatibilität liegt daran. Beispiel.
Dies bedeutet, dass es Phosphate von amorphen und kristallinen Calcios gibt. Aus diesem Grund ist es nicht überraschend, dass die Vielfalt und mehrere Optionen bei der Synthese von Materialien basierend auf Calciumphosphaten synthetisierten. Materialien, in deren Eigenschaften täglich mehr interessierte Forscher weltweit sind, um sich auf Knochenwiederherstellung zu konzentrieren.
Calciumphosphatstruktur
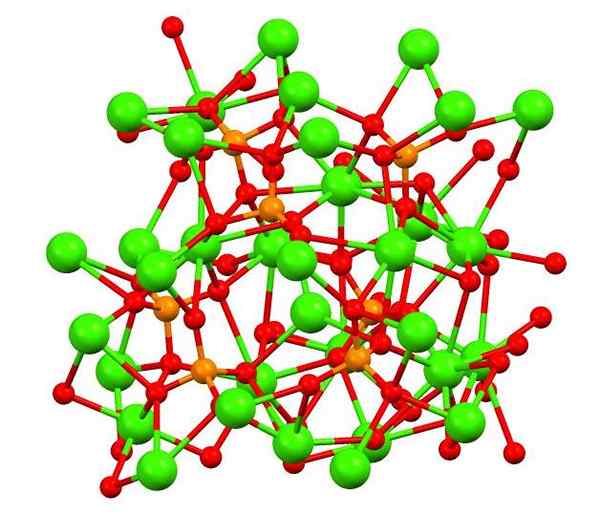 Kalziumphosphat im Whitlockita -Mineral. Quelle: Smokefoot [CC BY-SA 4.0 (https: // creativecommons.Org/lizenzen/by-sa/4.0)] aus Wikimedia Commons
Kalziumphosphat im Whitlockita -Mineral. Quelle: Smokefoot [CC BY-SA 4.0 (https: // creativecommons.Org/lizenzen/by-sa/4.0)] aus Wikimedia Commons Das obere Bild zeigt die Struktur des kalischen Tribasiens im seltsamen Whitlockita -Mineral, das Magnesium und Eisen als Verunreinigungen enthalten kann.
Obwohl es auf den ersten Blick komplex erscheinen mag, muss klargestellt werden, dass das Modell kovalente Wechselwirkungen zwischen den Sauerstoffatomen von Phosphaten und Calciummetallzentren annimmt.
Kann Ihnen dienen: Beryllium Hydrid (Beh2)Als Darstellung ist es jedoch gültig, die Wechselwirkungen sind jedoch elektrostatisch; das heißt, Ca -Kationen2+ Anziehung für Po spüren43- (AC2+- O-po33-). In diesem Sinne versteht man sich, warum im Bild Calcium (grüne Kugeln) von negativ geladenen Sauerstoffatomen (rote Kugeln) umgeben sind.
Wenn es so viele Ionen gibt, bleibt eine symmetrische Anordnung oder ein symmetrisches Muster nicht sichtbar. Die ca3(Po4)2 adoptiert bei niedrigen Temperaturen (t<1000°C) una celda unitaria correspondiente a un sistema cristalino romboédrico; a este polimorfo se le conoce con el nombre de β-Ca3(Po4)2 (β-TCP für sein Akronym in Englisch).
Bei hohen Temperaturen wird es andererseits zum α-Ca-Polymorph3(Po4)2 (α-TCP), dessen Einheitszelle einem monoklinen kristallinen System entspricht. Bei noch höheren Temperaturen kann auch das α'-Ca-Polymorph gebildet werden3(Po4)2, Das ist hexagonale kristalline Struktur.
Amorphes Calciumphosphat
Kristalline Strukturen für Calciumphosphat wurden erwähnt, was von einem Salz erwartet wird. Dies kann jedoch angezeigt werden.
In diesem Fall wird gesagt, dass Calciumphosphat eine amorphe Struktur (ACP) hat, Amorphes Calciumphosphat). Mehrere Autoren weisen auf diese Art von Struktur hin, die für die biologischen Eigenschaften der CA verantwortlich ist3(Po4)2 In Knochengeweben sind Reparatur und Biomimetisierung möglich.
Der Rest der Familie
Calciumphosphate sind in der Tat eine Familie anorganischer Verbindungen, die wiederum mit einer organischen Matrix interagieren können.
Die anderen Phosphate werden "einfach" erhalten, die die Anionen ändern, die Kalzium begleiten (po43-, HPO42-, H2Po4-, Oh-) wie die Art der Verunreinigungen im Feststoff. Somit können bis zu elf Kalzium oder mehr Phosphate mit jeweils ihrer eigenen Struktur und Eigenschaften auf natürliche oder künstliche Entstehung entstehen.
Einige Phosphate und ihre jeweiligen chemischen Strukturen und Formeln werden nachstehend erwähnt:
-Wasserstoff Dihydrado Calciumphosphat, CAHPO4∙ 2H2O: monoklin.
Kann Ihnen dienen: Ammoniumoxalat-Dihydrogen -monohydratisiertes Calciumphosphat CA (H2Po4)2∙ h2O: Triklin.
-Wasserfreies Deasephosphat, CA (H)2Po4)2: Triclinic.
-Wasserstoff octacalcic phosphat (OCP), CA8H2(Po4)6: Triclinic. Es ist ein Vorläufer in der Synthese von Hydroxyapatit.
-Hydroxyapatit, ca5(Po4)3OH: Sechseckalal.
Physikalische und chemische Eigenschaften
Namen
-Calciumphosphat
-Tricalcium -Phosphat
-Triccal Diphosphat
Molekulargewicht
310.74 g/mol.
Physische Beschreibung
Es ist ein weißer Feststoff.
Geschmack
Geschmacklos.
Schmelzpunkt
1670 ºK (1391 ºC).
Löslichkeit
-Praktisch unlöslich im Wasser.
-Unlöslich in Ethanol.
-Löslich in Salzsäure und verdünnte Salpetersäure.
Dichte
3,14 g/cm3.
Brechungsindex
1.629
Standardtrainingenthalpie
4126 kcal/mol.
Lagertemperatur
2-8 ºC.
pH
6-8 in einer wässrigen Suspension von 50 g/l Calciumphosphat.
Ausbildung
Calcium- und Wasserstoffnitrat -Ammoniumphosphat
Es gibt zahlreiche Methoden zur Herstellung oder Bildung von Kalziumphosphat. Eine von ihnen besteht aus einer Mischung aus zwei Salzen, CA (nein3)2∙ 4h2Oder, und (nh4)2HPO4, zuvor in absolutem Alkohol und Wasser gelöst. Ein Salz trägt Calcium und das andere Phosphat bei.
Aus dieser Mischung schlägt der ACP aus, das dann in einem Ofen bei 800 ° C und 2 Stunden erhitzt wird. Infolge dieses Verfahrens wird β-CA erhalten3(Po4)2. Sorgfältig kontrollierende Temperaturen, Agitation und Kontaktzeiten, kann die Bildung von Nanocristalen auftreten.
Um das α-CA-Polymorph zu bilden3(Po4)2 Es ist notwendig, das Phosphat über 1000 ° C zu erhitzen. Diese Erwärmung wird in Gegenwart anderer Metallionen durchgeführt, die dieses Polymorph so stark stabilisieren, damit es bei Raumtemperatur verwendet werden kann. Das heißt, es bleibt in einem stabilen Zielzustand.
Kalziumhydroxid und Phosphorsäure
Calciumphosphat kann auch durch Mischen von Calciumhydroxid- und Phosphorsäurelösungen gebildet werden, die eine Säure-Base-Neutralisation auftreten. Nach einem halben Tag der Reifung in den Muttergeistern und ihrer gebührenden Filtration, Waschen, Trocknen und Sifted wird ein körniger Staub amorpher Phosphat erhalten, ACP erhalten.
Dieses ACP reagiert Produkte mit hohen Temperaturen und transformiert nach den folgenden chemischen Gleichungen:
2ca9(HPO4) (Po4)5(OH) => 2CA9(P2ENTWEDER7)0,5(Po4)5(Oh) + h2O (a t = 446,60 ° C)
2ca9(P2ENTWEDER7)0,5(Po4)5(OH) => 3CA3(Po4)2 + 0,5H2O (a t = 748,56 ° C)
Kann Ihnen dienen: Selen: Geschichte, Eigenschaften, Struktur, erhalten, verwendet, verwendetAuf diese Weise wird die β-CA erhalten3(Po4)2, Ihr häufigste und stabilste Polymorph.
Anwendungen
Im Knochengewebe
Die ca3(Po4)2 Es ist der wichtigste anorganische Bestandteil der Knochenasche. Es ist ein Bestandteil von Knochenersatztransplantationen, was durch seine chemische Ähnlichkeit mit den im Knochen vorhandenen Mineralien erklärt wird.
Biomaterialien von Calciumphosphat werden verwendet, um Knochdefekte zu korrigieren und Metallprothesen abzudecken. Calciumphosphat wird auf sie abgelagert, isoliert sie aus der Umwelt und verlangsamt den Korrosionsprozess des Titans.
Biocerama -Zemente
Calciumphosphatzement (CPC) ist ein weiterer Bioceramic, der bei der Reparatur von Knochengewebe verwendet wird. Es wird ausgearbeitet, indem der Staub verschiedener Arten von Calciumphosphaten mit Wasser gemischt wird und eine Paste bildet. Nudeln können injiziert oder auf den Knochendefekt oder Hohlraum eingestellt werden.
Die Zement.
Ärzte
-Die ca3(Po4)2 Es ist ein Basissalz, daher wird es als Antazida verwendet. Bei Zahnnudeln liefert eine Kalzium- und Phosphatquelle.
-Es wird auch als Nahrungsergänzungsmittel verwendet, obwohl der wirtschaftlichste Weg zur Versorgung von Kalzium besteht darin, sein Carbonat und Citrat zu verwenden.
-Calciumphosphat kann bei der Behandlung von Tethany, latenter Hypokalzämie und Erhaltungstherapie verwendet werden. Darüber hinaus ist es bei der Kalziumergänzung während der Schwangerschaft und des Stillens nützlich.
-Es wird bei der Behandlung der Kontamination mit radioaktivem Isotopos-Radio (RA-226) und Strontium (SR-90) verwendet. Calciumphosphat blockiert die Absorption von radioaktiven Isotopos im Verdauungstrakt und begrenzt so die durch sie verursachten Schäden.
Andere
-Calciumphosphat wird als Futter für Vögel verwendet. Außerdem wird es in Zahnpasten zur Kontrolle des Tartars verwendet.
-Es wird als anti -gomerantes Mittel verwendet, um beispielsweise zu verhindern, dass Tischsalz kompakt ist.
-Es funktioniert als Bleichmittel des Mehls. In der Cochino -Butter verhindert in der Zwischenzeit eine unerwünschte Färbung und verbessert den Bratenzustand.
Verweise
- Calciumphosphat. Erholt von: Pubchem.NCBI.NLM.NIH.Regierung
- Calciumphosphat. Wissenschaft direkt. Abgerufen von: Scientedirect.com
- « Geschichte und Bedeutung der indonesischen Flagge
- Tlachichinol Was ist, Merkmale, Vorteile, Anwendung »

