Mindestformel, wie die Mindestformel, Beispiele und Übungen entfernen
- 3325
- 800
- Ivan Pressler
Der Minimum oder empirische Formel Es ist Ausdruck des Anteils, in dem die Atome der verschiedenen Elemente, die eine chemische Verbindung bilden. Die Mindestformel ist daher die einfachste Darstellung einer chemischen Verbindung. Dies ist auf "Minimum" zurückzuführen.
Die Mindestformel drückt nicht die Atomnummern der verschiedenen Elemente aus, die eine chemische Verbindung bilden. aber der Anteil, in dem diese Atome kombiniert werden, um die chemische Verbindung zu erzeugen.
 Diese minimale Formel zeigt kaum, dass die Verbindung die gleichen Mengen an Kohlenstoff- und Sauerstoffatomen und doppelten Wasserstoffatomen aufweist. Quelle: Gabriel Bolívar.
Diese minimale Formel zeigt kaum, dass die Verbindung die gleichen Mengen an Kohlenstoff- und Sauerstoffatomen und doppelten Wasserstoffatomen aufweist. Quelle: Gabriel Bolívar. Die minimale Formel wird auch als empirische Formel bezeichnet, da sie aus dem Experimentieren erhalten wird; Das heißt, es hängt mit der Erfahrung zusammen. Experimentelle Beobachtung ermöglicht zu dem Schluss, dass zwei Wasserstoffatome mit einem Wasserstoffatom zur Bildung von Wasser (H2ENTWEDER).
In vielen Fällen fällt die minimale Formel mit der molekularen Formel zusammen. Im Molekular erscheinen die realen Anzahl der verschiedenen Elemente, die eine chemische Verbindung bilden; Dies ist beispielsweise Schwefelsäure (h2SW4).
In anderen Fällen besteht jedoch kein Zufall der Mindestformel und der molekularen Formel. Dies ist der Fall von Benzol: Die Mindestformel ist C., während ihre molekulare Formel C ist6H6.
[TOC]
So erhalten Sie die Mindestformel?
Erster Schritt
Finden Sie die Gramme jedes in der Verbindung vorhandenen Elements. Wie normalerweise als Prozentsatz der Masse der Verbindung ausgedrückt, muss eine einfache Berechnung für die Transformation des Massenmassenprozentsatzes der Elemente durchgeführt werden.
Zweiter Schritt
Die relative Anzahl der Atome der verschiedenen Elemente, die die chemische Verbindung bilden. Dazu ist die Masse jedes Elements in Gramm zwischen seiner Atommasse unterteilt.
Einige Autoren bevorzugen es, die relative Anzahl von Atomen wie die Anzahl der Mol der Atome der Elemente zu bezeichnen, die Teil der chemischen Verbindung sind.
Kann Ihnen dienen: Butanal: Struktur, Eigenschaften, Verwendung und RisikenDritter Schritt
Erhalten des Mindestanteils, exprimiert in ganz Zahlen, jeder der in der chemischen Verbindung vorhandenen Atome.
Um diese Werte zu finden, werden die relativen Anzahl jedes in der Verbindung zwischen dem relativen numerischen Wert vorhandenen Atom in der chemischen Verbindung geteilt.
Für den Fall, dass der Wert des Mindestanteils eines Atoms ohne Dezimalstellen keine Ganzzahl ist, müssen alle Werte des Mindestanteils mit einer Zahl multipliziert werden. Auf diese Weise können alle Werte des Mindestanteils ganze Zahlen sind.
Zum Beispiel, wenn der Wert des Mindestanteils eines Atoms der chemischen Verbindung 2 beträgt.5, muss multipliziert werden alle die Werte des Mindestanteils jeder der vorhandenen Atome durch 2. Somit sind alle Werte des Mindestanteils nur ganze Zahlen.
Vierter Schritt
Schreiben Sie die minimale Verbundformel. Die Werte des minimalen Anteils für die Atome der verschiedenen Elemente werden als Index der chemischen Symbole von Elementen für die Schreiben der Mindestformel platziert.
Beispiele für Mindestformel
Wasser- und Kohlendioxid
Die meisten chemischen Verbindungen haben Formeln, die gleichzeitig minimale und molekulare Formeln sind. So die Wasserformel (h2O) ist eine minimale Formel; Es ist aber auch eine molekulare Formel. Gleiches gilt für die Kohlendioxidformel (CO2).
Basis- und Säureoxide
Basisoxide und Säuren sind chemische Verbindungen mit chemischen Formeln, es sei denn. Die gleiche Situation tritt mit Hydroxiden und Säuren auf, mit Ausnahme einiger Carbonsäuren.
Kann Ihnen dienen: Acetonitril (C2H3n)Essigsäure
Carboxysäuren mit einer Paarzahl von Kohlenstoffatomen in ihrer Zusammensetzung sind getrennt, eine minimale Formel und eine molekulare Formel. Essigsäure zum Beispiel hat eine molekulare Formel (C2H4ENTWEDER2); Es zeigt aber auch eine minimale Formel (CHO2ENTWEDER).
Buttersäure
Auch Bannesäure hat eine molekulare Formel (C4H8ENTWEDER2) und eine minimale Formel (c2H4ENTWEDER).
Ethylenglykol
Andere organische Verbindungen haben die beiden Arten chemischer Formeln; Dies ist der Fall von Ethylenglykol, das eine molekulare Formel hat (C2H6ENTWEDER2) und eine Mindestformel (Cho3ENTWEDER).
Benzol
Benzol, eine aromatische Verbindung, hat eine molekulare Formel (C6H6) und eine Mindestformel (CH).
Glucose
Glukose hat eine molekulare Formel (C6H12ENTWEDER6) und eine Mindestformel (Cho2ENTWEDER).
Gelöste Übungen
- Übung 1
Ethylenglykol ist eine Verbindung, die als Frostschutzmittel verwendet wird, ein Molekulargewicht von 62,1 g/mol und eine nächste Massenprozentsatzzusammensetzung:
C: 38 %,
H: 9,7 %
O: 51,16 %.
Erster Schritt
Drücken Sie die Massenprozentsätze der Elemente in ihren Massen in Gramm aus. Dazu wird das Molekulargewicht von Ethylenglicol als Referenz genommen. Wenn dies 62,1 Gramm pro Mol ist, besteht 38% derselben aus Kohlenstoff. Und so weiter mit den anderen Elementen:
Kohlenstoffmasse = 62,1 g · (38/100)
= 23,6 g
Wasserstoffmasse = 62,1 g · (9,7/100)
= 6,024 g
Sauerstoffmasse = 62,1 g · (51,16/100)
= 31,77 g
Zweiter Schritt
Berechnen Sie die relative Anzahl jedes gegenwärtigen Atoms (NRA) oder die Anzahl der Mol jedes Atoms. Dazu ist die Masse jedes chemischen Elements durch seine Atommasse geteilt.
Nra (c) = 23,6 g / 12 g
= 1,97
Es kann auf 2 gerundet werden.
NRA (H) = 6.024 g / 1 g
= 6.024
Es kann um 6 gerundet werden.
NRA (O) = 31,77 g /16 g
= 1.985
Es kann auf 2 gerundet werden.
Dritter Schritt
Berechnen Sie den Mindestanteil der gesamten Anzahl der Elemente der Verbindung (PMNE). . .
Es kann Ihnen dienen: PropanäurePmne (c) = 2/2
= 1
PMNE (H) = 6/2
= 3
= 1
Vierter Schritt
Schreiben Sie die minimale Formel von Ethylenglykol:
CH3ENTWEDER
Wie zu sehen ist, sind die in Schritt 3 erhaltenen Werte die Indexs der zusammengesetzten Elemente.
- Übung 2
Essigsäure hat ein Molekulargewicht von 60 g/mol und eine nach Massenprozentsatzzusammensetzung:
Erhalten Sie die minimale Verbindungsformel.
Erster Schritt
Verwandeln Sie die Massenprozentsätze der Elemente in ihre Massen, die in Gramm ausgedrückt werden:
Kohlenstoffmasse = 60 g · (40/100)
= 24 g
Wasserstoffmasse = 60 g · (6,67/100)
= 4 g
Sauerstoffmasse = 60 g · (53,33/100)
Zweiter Schritt
Berechnen Sie die relative Anzahl der Atome (NRA) der Verbindung. Dazu sind die Massen der Elemente zwischen ihren Atommassen aufgeteilt:
Nra (c) = 24 g / 12 g
= 2
NRA (H) = 4 g / 1 g
= 4
NRA (O) = 32 g / 16 g
= 2
Dritter Schritt
Erhalten Sie den Mindestanteil der gesamten Anzahl der Elemente der Verbindung (PMNE).
Pmne (c) = 2/2
= 1
Pmne (h) = 4/2
= 2
Pmne (o) = 2/2
= 1
Vierter Schritt
Schreiben Sie die minimale Formel von Essigsäure:
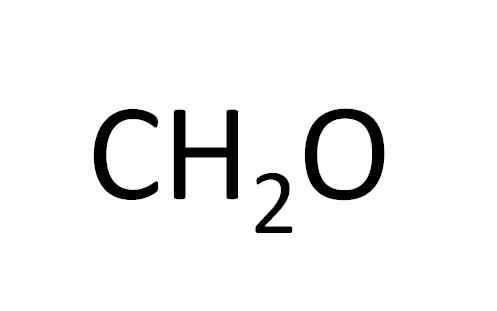
CH2ENTWEDER
Die Einschüsse der Verbindung sind die von PMNE erhaltenen Werte.
Verweise
- Whitten, Davis, Peck & Stanley. (2008). Chemie. (8. Aufl.). Cengage Lernen.
- Helmestine, Anne Marie, ph.D. (27. August 2019). Empirische Formel: Definition und Beispiel. Erholt von: thoughtco.com
- Wikipedia. (2020). Empirische Formel. Abgerufen von: in.Wikipedia.Org
- Chemistry Librettexts. (3. Juli 2019). . Erholt von: Chem.Librettexts.Org
- Nicola McDougal. (2020). . Lernen. Erholt von: Studium.com
- « Irreversible Reaktionsmerkmale und Beispiele
- Molekulare Formel, wie sie es herausholen, Beispiele und Übungen »

