Molekulare Formel, wie sie es herausholen, Beispiele und Übungen
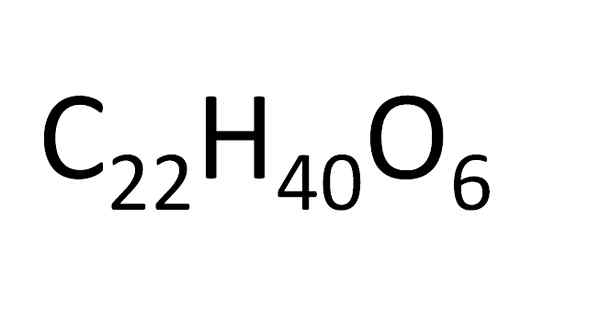
- 5048
- 1633
- Frederike Birkemeyer
Der Molekularformel Es ist eine Darstellung eines Moleküls einer Verbindung, in dem sie durch seine chemischen Symbole angezeigt werden. Jedes Atom wird von einem Index begleitet.
Die molekulare Formel hat die Einschränkung, die nicht die Verbindungen der verschiedenen Atome des Moleküls oder ihrer räumlichen Beziehung anzeigt; wie durch die strukturelle Formel ausgedrückt. In einigen Fällen ist es nicht spezifisch, zum Beispiel: C6H12ENTWEDER6 Es ist die molekulare Formel von Glukose, Galaktose und Fructose.
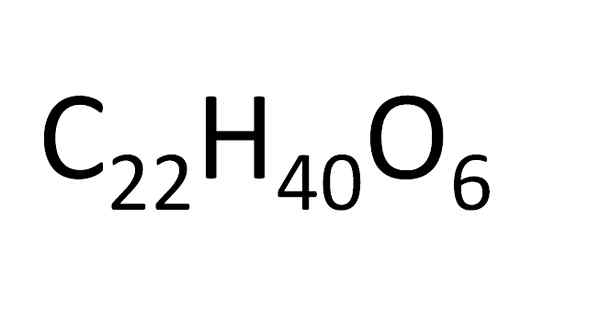 Aus derselben molekularen Formel können endlose isomere Verbindungen erhalten werden. Dies entspricht einer organischen Verbindungsvariablen mit hoher Molekularmasse. Quelle: Gabriel Bolívar.
Aus derselben molekularen Formel können endlose isomere Verbindungen erhalten werden. Dies entspricht einer organischen Verbindungsvariablen mit hoher Molekularmasse. Quelle: Gabriel Bolívar. Es gibt eine Reihe von Regeln für die Entsorgung von Atomen in einer molekularen Formel. Für Ionensalze, zum Beispiel Natriumchlorid, wird das Kationssymbol zuerst platziert (Na+) und dann das Anionensymbol (cl-). Aus diesem Grund ist die molekulare Formel von Natriumchlorid NaCl.
Die molekulare Formel organischer Verbindungen wird geschrieben, indem zuerst das Kohlenstoffsymbol (c) platziert wird, gefolgt vom Wasserstoffsymbol (H) und dann der verbleibenden Atome. Zum Beispiel ist die molekulare Formel von Essigsäure c2H4ENTWEDER2.
[TOC]
Wie man die molekulare Formel bekommt
Das Erhalten der molekularen Formel einer Verbindung basiert auf der vorherigen Etablierung der minimalen oder empirischen Formel derselben. Aus diesem Grund sind die anfänglichen Schritte zum Erhalten beider Formeln üblich.
Erster Schritt
Die Expression der Masse der Elemente einer chemischen Verbindung in einer prozentualen Form ist üblich. Eine einfache Berechnung muss dann durchgeführt werden.
Kann Ihnen dienen: prozentuale KonzentrationZweiter Schritt
Wenn Sie die Masse in Gramm jedes Elements und ihre Atommasse kennen, können Sie die relative Anzahl jedes Atoms oder die Anzahl der Mol jedes Atoms erhalten, die die Masse jeder der verschiedenen Elemente zwischen seiner Atommasse teilen.
Dritter Schritt
Die relative Anzahl von alle Atome zwischen der relativen Anzahl des niedrigeren Werts. Die minimalen Anteilswerte müssen eine ganze Zahl sein. Für den Fall, dass ein Wert des Verhältnisses eine Dezimalzahl enthält, muss eine Korrektur vorgenommen werden, die dazu führt.
Die Korrektur besteht darin, alle Werte des Verhältnisses mit einer Zahl zu multiplizieren, die zu allen Werten zurückkehrt. Zum Beispiel, wenn ein Mindestanteilswert 1 beträgt.25, alle Werte müssen mit vier multipliziert werden (4). Seit 1.25 multipliziert mit 4 ist gleich 5, eine Ganzzahl.
Vierter Schritt
Alle chemischen Symbole der Elemente der Verbindung werden platziert und mit ihrem entsprechenden Index; das heißt, der Wert des Mindestanteils des Elements.
Fünfter Schritt
Die minimale Formel einer Verbindung kann in ihre molekulare Formel transformiert werden, indem die Beziehung zwischen dem Molekulargewicht der Verbindung und dem Gewicht ihrer minimalen Formel (n) erhalten wird. Diese Beziehung ist die gleiche, die zwischen der molekularen Formel und der minimalen Formel besteht.
n = Molekulargewicht der Verbindung / Gewicht der minimalen Formel
Um die molekulare Formel zu erhalten, muss die minimale Formel mit n multipliziert werden. Dies impliziert, dass jeder der Einweise der Mindestformel mit n multipliziert werden muss.
n = Molekulargewicht / minimales Formelgewicht
= Molekülformel / Mindestformel
Kann Ihnen dienen: Sauerstoff: Eigenschaften, Struktur, Risiken, verwendetMolekülformel = N · Mindestformel
Beispiele für molekulare Formeln
Im Folgenden finden Sie einige häufige molekulare Formeln:
-Eisenoxid (hässlich)
-Natriumhydroxid (NaOH)
-Kaliumoxid (k)2ENTWEDER)
-Perchloroxid (CL2ENTWEDER7)
-Eisenhydroxid [Glaube (OH)3]
-Kalziumchlorid (CACL2)
-Salzsäure (HCL)
-Natriumsulfat (n2SW4)
-Schwefelsäure (h2SW4)
-Perbromsäure (Hbro4)
-Aluminiumchlorid (Alcl3)
-Methan (Ch4)
-Propan (c3H8)
-Etano (c2H6)
-Ethylalkohol (C2H6ENTWEDER)
-Essigsäure (c)2H4ENTWEDER2)
-Benzol (c6H6)
-Glukose (c6H12ENTWEDER6)
Gelöste Übungen
- Übung 1
Metylbenzoat hat die folgenden Massenprozentsätze:
C: 70,57 %,
H: 5,93 %
O: 23,49 %
Und ein Molekulargewicht von 136,1 g/mol. Bestimmen Sie die molekulare Formel.
Erster Schritt
Der erste Schritt besteht darin, die Massenprozentsätze der Elemente in ihren Massen in Gramm auszudrücken und zu wissen, dass die Massenprozentsätze in Bezug auf das Molekulargewicht stehen.
Von den 136,1 Gramm, die dem Mol der Verbindung entsprechen, entspricht 70,57% nur Kohlenstoff. Und so weiter mit den verbleibenden Elementen:
Kohlenstoffmasse = 136,1 g · (70,57/100)
= 96,05 g
Wasserstoffmasse = 136,1 g · (5,93/100)
= 8,06 g
Sauerstoffmasse = 136,1 · (23,49/100)
= 31,96 g
Zweiter Schritt
Bei der Ausarbeitung der molekularen Formel muss die relative Anzahl der Atome (NRA) bestimmt werden. Dazu sind die Massen der Elemente zwischen ihren Atommassen aufgeteilt:
Nra (c) = 96 g / 12 g
= 8
NRA (H) = 8 g / 1 g
= 8 g
NRA (O) = 32 g / 16 g
= 2
Dritter Schritt
Wir müssen dann die Mindestanteile der Elemente (PME) berechnen. Dafür sind alle NRA -Werte zwischen dem Wert der minderjährigen NRA aufgeteilt:
PME (c) = 8/2
= 4
PME (H) = 8/2
= 4
Pme (o) = 2/2
= 1
Vierter Schritt
Schreiben Sie die minimale Formel von Methylbenzoat, basierend auf der Tatsache, dass die Indexs der Elemente ihre minimalen Anteile berechnet sind:
Kann Ihnen dienen: Natriumdichromat (Na2CR2O7): Eigenschaften, Produktion, verwendetC4H4ENTWEDER
Fünfter Schritt
Schließlich muss die molekulare Formel von Methylbenzoat festgelegt werden. Wir berechnen dann:
n = Molekulargewicht / minimales Formelgewicht
Das minimale Formelgewicht beträgt 68 g/mol:
= 136,1 g / 68 g
n ≈ 2
Molekülformel = 2 · Mindestformel
= 2 · c4H4ENTWEDER
Molekülformel von Methylbenzoat = C8H8ENTWEDER2
- Übung 2
Die Prozentsätze der Elemente, die Benzol bilden, sind folgende:
C: 92,36 %
H: 7,64 %.
Das Molekulargewicht von Benzol beträgt 78 g/mol. Bestimmen Sie seine molekulare Formel.
Erster Schritt
Verwandeln Sie die Massenprozentsätze der Elemente in ihre Massen in Gramm:
Kohlenstoffmasse = 78 g · (92,36/100)
= 72,04 g
Wasserstoffmasse = 78 g · (7,64/100)
= 5,96 g
Zweiter Schritt
Berechnung der relativen Anzahl der Atome (NRA). Dazu sind die Massen der Elemente zwischen ihren Atommassen aufgeteilt:
Nra (c) = 72 g / 12 g
= 6
NRA (H) = 6 g / 1 g
= 6
Dritter Schritt
Berechnung der Werte des Mindestanteils der Elemente (PME). Dies wird berechnet, indem die NRA -Werte aller Elemente zwischen dem niedrigeren Wert der NRA geteilt werden:
PME (c) = 6/6
= 1
PME (H) = 6/6
= 1
Vierter Schritt
TEED der Mindestbenzolformel unter Berücksichtigung, dass die Indexs der Elemente die Werte des berechneten minimalen Anteils sind.
Mindestbenzolformel: CH
Fünfter Schritt
Etablierung der molekularen Formel durch Berechnung der Beziehung zwischen der molekularen Masse und der Masse der minimalen Formel:
n = Molekulargewicht / minimales Formelgewicht
= 78 g / 13 g
n = 6
Molekülformel = N · Mindestformel
= 6 · ch
= C6H6
Verweise
- Whitten, Davis, Peck & Stanley. (2008). Chemie. (8. Aufl.). Cengage Lernen.
- Wikipedia. (2020). Chemische Formel. Abgerufen von: in.Wikipedia.Org
- Grenzenloses Lernen. (S.F.). Molekulare Formeln. Erholt von: Kurse.Lumenarning.com
- Helmestine, Anne Marie, ph.D. (29. September 2019). Empirische und molekulare Berechnungsformeln. Erholt von: thoughtco.com
- Peter J. Mikulecky, Chris Hren. (2020). Wie man empirische Formeln verwendet, um molekulare Formeln zu finden. Erholt von: Dummies.com
- « Mindestformel, wie die Mindestformel, Beispiele und Übungen entfernen
- Globalisierungsgeschichte, Merkmale, Ursachen, Folgen »

