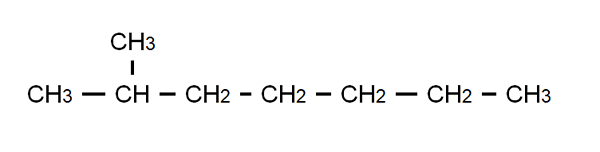
- 4841
- 797
- Frederike Birkemeyer
Der Semi -entwickelte Formel, Auch als semi -strukturelle Formel bezeichnet, ist es eine der vielen möglichen Darstellungen, die dem Molekül einer Verbindung gegeben werden können. Es ist in der organischen Chemie sehr wiederkehrend, insbesondere in akademischen Texten, da es damit die richtige Reihenfolge eines Moleküls und seiner kovalenten Bindungen gezeigt wird.
Im Gegensatz zur entwickelten Formel, die der strukturellen Formel übereinstimmt, zeigt sie die C-H-Bindungen nicht und ließ sie aus, um die Darstellung zu vereinfachen. Aus dieser Formel kann jeder Leser verstehen, was das Skelett eines Moleküls ist. Aber nicht seine Geometrie oder eine der stereochemischen Aspekte.
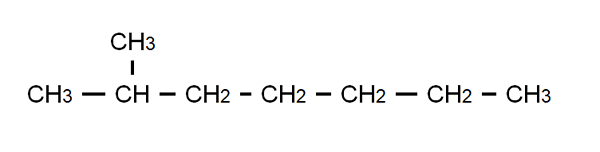 Semi-entwickelte Formel des 2-Methylheptano. Quelle: Gabriel Bolívar.
Semi-entwickelte Formel des 2-Methylheptano. Quelle: Gabriel Bolívar. Um diesen Punkt zu verdeutlichen, haben wir die semi-entwickelte Formel des 2-methylheptano8H18, und das folgt der allgemeinen Formel CNH2n+2. Beachten Sie, dass die molekulare Formel absolut nichts über die Struktur sagt, während das halb entwickelte sie ermöglicht, sich zu visualisieren, was diese Struktur ist.
Beachten Sie ebenso, dass C-H-Bindungen weggelassen werden und nur die C-C-Bindungen hervorheben, aus denen die kohlensäurehaltige Kette oder das Skelett besteht. Es ist zu sehen, dass für einfache Moleküle die entwickelte Formel mit der kondensierten Formel zusammenfällt; und sogar mit Molekular.
[TOC]
Beispiele
Methan
Die molekulare Formel von Methan ist Cho4, Nun, es hat vier C-H-Verbindungen und ist eine tetraedrische Geometrie. Diese Daten werden von der strukturellen Formel mit Keilen außerhalb oder unterhalb der Ebene bereitgestellt. Für Methan wird die kondensierte Formel auch Cho4, Wie empirisch und halbentwickelt. Dies ist die einzige Verbindung, für die die Singularität erfüllt wird.
Der Grund, warum die halb entwickelte Formel von Methan Cho ist4, Es liegt daran, dass ihre C-H-Links nicht geschrieben sind; Dazu würde es der strukturellen Formel entsprechen.
Kann Ihnen dienen: SolvationPropan
Die semi -entwickelte Formel von Propan ist Cho3-CH2-CH3, Nur zwei C-C-Links haben. Sein Molekül ist linear, und wenn es zeigt, ist seine kondensierte Formel genau das gleiche: Cho3CH2CH3, Mit dem einzigen Unterschied, dass C-C-Links weggelassen werden. Für das Propan ist es erfüllt, dass sowohl die halb entwickelte als auch die kondensierte Formel übereinstimmen.
Tatsächlich wird dies für alle Alkane von linearen Ketten erfüllt, da sie in den folgenden Abschnitten weiterhin zu sehen sind.
Butan
Die semi -entwickelte Butanformel ist Cho3-CH2-CH2-CH3. Beachten Sie, dass es in derselben Zeile geschrieben werden kann. Diese Formel entspricht streng der der der N-Butan, der darauf hinweist, dass es das lineare und ungeforste Isomer ist. Das verzweigte Isomer, das 2-Methylpropan, hat die folgende halb entwickelte Formel:
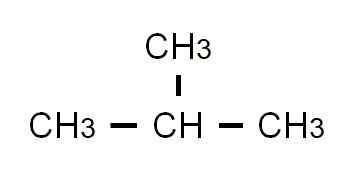 Halb entwickelte Formel von 2-Methylpropan. Quelle: Gabriel Bolívar.
Halb entwickelte Formel von 2-Methylpropan. Quelle: Gabriel Bolívar. Diesmal kann es nicht mehr in derselben Zeile geschrieben oder dargestellt werden. Diese beiden Isomere haben die gleiche molekulare Formel: C4H10, was nicht dazu dient, voneinander zu diskriminieren.
Pentano
Wir haben wieder ein weiteres Alkane: Der Pentan, dessen molekulare Formel C ist5H12. Die semi -entwickelte Formel der N-Pentano ist ch3-CH2-CH2-CH2-CH3, Leicht zu repräsentieren und zu interpretieren, ohne die C-H-Links zu platzieren. Die Gruppen ch3 Sie sind das sogenannte Methyl oder Methyl und die Choons2 Sie sind Methylen.
Der Pentan hat andere verzweigte strukturelle Isomere, die im unteren Bild beobachtet werden, das durch ihre jeweiligen halb entwickelten Formeln dargestellt wird:
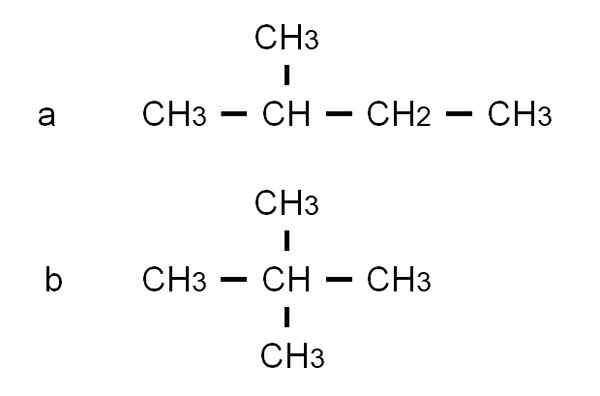 Semi -entwickelte Formeln der beiden verzweigten Isomere des Pentaner. Quelle: Gabriel Bolívar.
Semi -entwickelte Formeln der beiden verzweigten Isomere des Pentaner. Quelle: Gabriel Bolívar. Das Isomer Zu Es ist das 2-Methylbutane, auch Isopentano genannt. Inzwischen das Isomer B Es ist 2,2-Dimethylpropan, auch als Neopentano bekannt. Seine halb entwickelten Formeln machen den Unterschied zwischen den beiden Isomeren klar; Aber er sagt nicht viel darüber, wie solche Moleküle im Weltraum aussehen würden. Dazu würden strukturelle Formeln und Modelle erfolgen.
Kann Ihnen dienen: Sulfonsäure: Struktur, Nomenklatur, Eigenschaften, verwendetEthanol
Semi -entwickelte Formeln werden nicht nur für Alkane, Alkene oder Alkine verwendet, sondern für jede Art von organischer Verbindung. So hat Ethanol, ein Alkohol, eine halb entwickelte Formel: CH3-CH2-Oh. Beachten Sie, dass jetzt ein C-O-Link dargestellt ist, jedoch nicht der O-H-Link. Alle Wasserstoffbrückenbindungen werden verachtet.
Lineare Alkohole sind wie Alkane leicht zu repräsentieren. Zusammenfassend: Alle halb entwickelten Formeln linearer Moleküle sind leicht zu schreiben.
Dimethyléter
Die Ether können auch mit semi -entwickelten Formeln vertreten werden. Im Fall von Dimethyléter, dessen molekulare Formel C ist2H6Oder das halb entwickelte ist: cho3-O-ch3. Beachten Sie, dass Dimethyléter und Ethanol strukturelle Isomere sind, da sie dieselbe molekulare Formel haben (sagen Sie die Atome von C, H und O).
Cyclohexan
Semi -entwickelte Formeln für verzweigte Verbindungen sind mühsamer als linear; Aber es gibt noch mehr zyklische Verbindungen wie Cyclohexan. Seine molekulare Formel entspricht ihr wie für Hexen und seine strukturellen Isomere: C6H12, Seit dem hexagonalen Ring zählt als Ungesättigtheit.
Um den Cyclohexan zu repräsentieren, wird ein sechseckiger Ring gezogen, an dessen Eckpunkte die Methylengruppen lokalisiert werden, CH2, Genau wie unten:
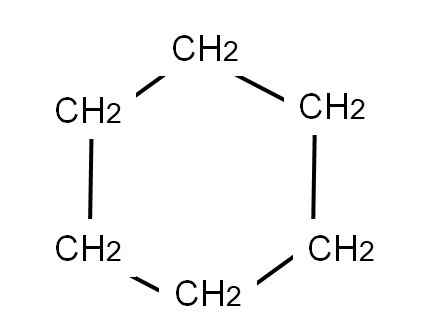 Cyclohexan semi -entwickelte Formel. Quelle: Gabriel Bolívar.
Cyclohexan semi -entwickelte Formel. Quelle: Gabriel Bolívar. Die entwickelte Formel des Cyclohexans würde die C-H-Links zeigen, als ob der Ring „Antennen“ des Fernsehens hätte.
Phosphorsäure
Die molekulare Formel von Phosphorsäure ist h3Po3. Für viele anorganische Verbindungen reicht die molekulare Formel aus, um eine Vorstellung von der Struktur zu haben. Es gibt jedoch mehrere Ausnahmen, und dies ist einer von ihnen. Mit der Tatsache, dass h3Po3 Es ist eine diprotische Säure, die halb entwickelte Formel lautet: HPO (OH)2.
Kann Ihnen dienen: Neopentil: Struktur, Eigenschaften, Nomenklatur, TrainingDas heißt. Formel H jedoch jedoch3Po3 Es gibt auch ein Molekül mit einer halb entwickelten Formel zu: PO (OH)3. Beide sind in der Tat das, was durch Tautomere bekannt ist.
Semi -entwickelte Formeln in der anorganischen Chemie sind denjenigen, die in der organischen Chemie kondensiert sind, sehr ähnlich. In anorganischen Verbindungen, weil sie keine C-H-Bindungen haben und um einfacher zu sein, reicht ihre molekularen Formeln normalerweise aus, um sie zu beschreiben (wenn sie kovalente Verbindungen sind).
Allgemeiner Kommentar
Semi -entwickelte Formeln sind sehr häufig, wenn der Schüler die Regeln der Nomenklatur lernt. Aber sobald sie assimiliert sind, sind die Chemienotizen im Allgemeinen mit Skelettstrukturformeln überfüllt. Das heißt.
Für den Rest sind in der organischen Chemie die kondensierten Formeln wiederkehrender als die halb entwickelten, da der erstere nicht einmal die Links wie in der Sekunde schreiben muss. Und in Bezug auf die anorganische Chemie werden diese halb entwickelten Formeln weniger verwendet.
Verweise
- Whitten, Davis, Peck & Stanley. (2008). Chemie. (8. Aufl.). Cengage Lernen.
- Wikipedia. (2020). Semi -entwickelte Formel. Geborgen von: ist.Wikipedia.Org
- Siyavula. (S.F.). Organische molekulare Strukturen. Erholt von: Siyavula.com
- Jean Kim & Kristina Bonnett. (5. Juni 2019). Organische Strukturen zeichnen. Chemistry Librettexts. Erholt von: Chem.Librettexts.Org
- Lehrer. Marl und Jla. (S.F.). Einführung in Kohlenstoffverbindungen. [PDF]. Abgerufen von: IPN.mx

