Phosphorgeschichte, Eigenschaften, Struktur, erhalten, verwendet, verwendet

- 3770
- 1159
- Ibrahim Steuk
Er passen Es ist ein nicht -metallisches Element, das durch das chemische Symbol P dargestellt wird und die Atomzahl 15 aufweist. Es präsentiert drei wichtigste allotropische Formen: weiß, rot und schwarzer Phosphor. Weißer Phosphor ist phosphoreszierend, verbrennt spontan, wenn es der Luft ausgesetzt ist und auch sehr giftig ist.
Weißer Phosphor bei 250 ° C Temperatur wird rotes Phosphor; eine polymere Form, unlöslich und das brennt nicht in der Luft. Bei hohen Temperaturen und Drücken sowie in Gegenwart oder nicht von Katalysatoren wird schwarzer Phosphor erhalten, der Graphit ähnelt und ein guter Stromleiter ist.
 Weißer Phosphor in einer Flasche mit Wasser gespeichert. Quelle: w. Oelen [CC BY-SA 3.0 (https: // creativecommons.Org/lizenzen/by-sa/3.0)]]
Weißer Phosphor in einer Flasche mit Wasser gespeichert. Quelle: w. Oelen [CC BY-SA 3.0 (https: // creativecommons.Org/lizenzen/by-sa/3.0)]] Phosphor wurde zum ersten Mal von H isoliert. Marke im Jahr 1669. Zu diesem Zweck wurde Urin als Quelle dieses Elements verwendet. 1770 w. Scheele entdeckte, dass er auch Knochenphosphor isolieren konnte.
Anschließend aufgrund der Schaffung des elektrischen Ofens durch J. Burgess Readman (1800), Phosphatgesteine wurden zur Hauptquelle für die Phosphorproduktion aus Fluoroapatiterz, in ihnen vorhanden.
Phosphor ist das zwölfreichere Element der Erdkruste und entspricht 0,1% davon. Darüber hinaus ist es das sechste Element im Überfluss im menschlichen Körper; hauptsächlich in Knochen in Form von Hydroxylapatit konzentriert.
Es ist daher ein wesentliches Element für Lebewesen, das zu einem der drei Hauptnährstoffe von Pflanzen wird. Phosphor ist Teil der chemischen Struktur von Nukleinsäuren; von Energiespeicherverbindungen (ATP), Coenzyme; und im Allgemeinen von Stoffwechselverbindungen.
[TOC]
Geschichte
- Entdeckung
Im Urin
 Joseph Wright von Derby -Malerei, wo die Phosphorentdeckung veranschaulicht. Quelle: Joseph Wright von Derby [Public Domain]
Joseph Wright von Derby -Malerei, wo die Phosphorentdeckung veranschaulicht. Quelle: Joseph Wright von Derby [Public Domain] Phosphor wurde 1669 von Henning Brand isoliert und war der erste Mensch, der ein Element isoliert hat. Marke war ein deutscher Alchemist aus Hamburg und gelang es, eine Phosphorverbindung aus dem Urin zu erhalten. Dazu sammelte er den Urin von 50 Eimer und erlaubte ihm, sich zu zersetzen.
Die Marke verdampfte dann den Urin und erhielt einen schwärzlichen Rückstand, der mehrere Monate lang zurückgehalten wurde. Zu diesem hinzugefügten Sand und erwärmt es, um Gase und Öle zu beseitigen. Schließlich erhielt er einen weißen Feststoff, der mit einer grünen Farbe im Dunkeln leuchtete, die er als "kaltes Feuer" bezeichnete.
Der Begriff "Phosphor" stammt zufällig aus dem griechischen Wort "Phosphor", was den Träger des Lichts bedeutet.
Marke hat ihre experimentellen Ergebnisse nicht veröffentlicht und sie an mehrere Alchemisten verkauft, darunter: Johann Kraft, Knunckel Lowenstern und Wilhelm Leibniz. Wahrscheinlich berichteten einige von ihnen über die Marke der Marke an der Akademie der Wissenschaften von Paris, wodurch ihre Untersuchungen verbreitet wurden.
Die Marke isolierte jedoch Phosphor nicht wirklich, sondern ammoniakales Natriumphosphat [NH (NH)4) Po4]. 1680 verbesserte Robert Boyle die Verfahren der Marke, durch die er eine alotrope Form von Phosphor erhalten konnte (P4).
In den Knochen
Johan Gottlieb Gahn und Carl Wihelm Scheele wurden 1769 gegründet, dass sich eine Phosphorverbindung, Calciumphosphat, in den Knochen befand. Die unglücklichen Knochen wurden einem Verdauungsprozess mit starken Säuren wie Schwefelsäure unterzogen.
Dann wurde das Verdauungsprodukt in Stahlbehältern mit Kohle und Kohle erhitzt, wodurch der weiße Phosphor durch Destillation in Retorte erhöht wurde. Die Knochen waren die Hauptquelle, die Phosphor bis 1840 erhielt, als sie für diesen Zweck vom Guano ersetzt wurden.
Im Guano
Guano ist eine Mischung aus Vögeln von Vögeln und Zersetzungsprodukten von ihnen. Es wurde im 19. Jahrhundert als Phosphor- und Düngemittelquelle verwendet.
- Industrielle Entwicklung
Phosphatgesteine wurden 1850 als Phosphorquelle verwendet. Dies machte zusammen mit der Erfindung des elektrischen Ofens, um die Felsen von James Burges Readman (1888) zu kalkinieren.
Im Jahr 1819 wurden Cerrillas -Fabriken eingerichtet, die die industrielle Entwicklung von Phosphor begannen.
Physikalische und chemische Eigenschaften
Aussehen
Abhängig von der allotropen Form kann es farblos, geschlossenes Weiß, Gelb, Scharlach, Rot, Violett oder Schwarz sein.
Atomares Gewicht
30.973 u
Atomnummer (z)
fünfzehn
Schmelzpunkt
Weißer Phosphor: 44,15 ºC
Roter Phosphor: ~ 590 ºC
Siedepunkt
Weißer Phosphor: 280,5 ºC
Dichte (Umgebungstemperatur)
Weiß: 1,823 g/cm3
Rot: 2,2-2,34 g/cm3
Violett: 2,36 g/cm3
Schwarz: 2,69 g/cm3
Fusionshitze
Weißer Phosphor: 0,66 kJ/mol
Verdampfungswärme
Weißer Phosphor: 51,9 kJ/mol
Molkalorienkapazität
Weißer Phosphor: 23.824 j/(Mol.K)
Oxidationszustände
-3, -2, -1, +1, +2, +3, +4 und +5
Abhängig von der Elektronegativität der Elemente, mit denen der Phosphor den Oxidationszustand +3 oder -3 zeigen kann. Phosphor reagiert im Gegensatz zum Stickstoff tendenziell vorzugsweise mit Oxidationszustand +5; Dies ist der Fall von Phosphorpentoxid (P2ENTWEDER5 oder p25+ENTWEDER52+).
Kann Ihnen dienen: lösliche MaterialienElektronegativität
2,19 auf der Paulingskala
Ionisationsenergie
-Erstens: 1.101 kJ/mol
-Zweitens: 2.190.7 kJ/mol
-Dritte: 2.914 kJ/mol
Wärmeleitfähigkeit
Weißer Phosphor: 0,236 W/(M · K)
Schwarzer Phosphor: 12,1 W/(m · k)
Es zeigt, wie schwarzer Phosphor fast sechsmal mehr Wärme durchführt als weißer Phosphor.
Magnetische Ordnung
Weiß, Rot, Violett und schwarze Streichhölzer sind diamagnetisch.
Isotope
Phosphor hat 20 Isotope, die die wichtigsten sind: 31P, das einzige stabile Isotop mit einer Fülle von 100%; 32P, Emitter -β -Isotop- und mit einem halben Leben von 14,28 Tagen; Und 33P, ein β -Emitter -Isotop- Und mit einem halben Leben von 25,3 Tagen.
Phosphoreszenz
Weißer Phosphor ist phosphoreszierend und emittiert ein grünes Licht im Dunkeln.
Allotrope Veränderungen
Weißer Phosphor ist instabil und Veränderungen zu Temperaturen nahe 250 ° C zu einer polymeren Form. Es ist eine amorphe Substanz, kann aber kristallin werden; Scheint nicht im Dunkeln oder brennt in der Luft.
Weißer Phosphor bei hohen Temperaturen und Drücken oder in Gegenwart von Katalysatoren wird in eine andere polymere Form als den roten Phosphor umgewandelt: schwarzer Phosphor. Dies ist eine schwarze, inerte kristalline Substanz, ähnlich wie Graphit, und das hat die Fähigkeit, Elektrizität zu leiten.
Löslichkeit
Weißer Phosphor rein ist in Wasser unlöslich, obwohl es in Kohlenstoffsulfid solubilisiert werden kann. In der Zwischenzeit sind rote und schwarze Spiele im Wasser unlöslich und weniger flüchtig als weißer Phosphor.
Reaktivität
Phosphor verbrennt spontan in der Luft, um das p zu bilden2ENTWEDER5, Und dies kann wiederum mit drei Wassermolekülen reagieren, um orthophosphor oder phosphorsäure (h) zu bilden3Po4).
Durch Wirkung von heißem Wasser entsteht Phosphin (pH)3) und Phosphor -Oxaziden.
Phosphorsäure wirkt auf phosphatierte Gesteine, die Dihydrogen oder Superphosphat -Calciumphosphat verursachen [CA2Po4)2].
Sie können mit Halogenen reagieren, um die PX -Halogenide zu bilden3, X bis F, CL, Br oder I darstellen; o Haluros mit PX -Formel5, X, CL oder Br sein.
Auch Phosphor reagiert mit Metallen und Metalloiden, um Phosphide zu verursachen, und Schwefel, um mehrere Sulfide zu bilden. Andererseits bindet es an Sauerstoff, um Ester zu stammen. Auf die gleiche Weise wird es mit Kohlenstoff kombiniert, um die organischen Phosphor -Verbindungen zu bilden.
Elektronische Struktur und Konfiguration
- Links und tetraedrische Einheit
Phosphoratome haben die folgende elektronische Konfiguration:
[Ne] 3s2 3p3
Daher fünf Elektronen aus Valencia, wie Stickstoff und die anderen Elemente der Gruppe 15. Da es sich um ein nicht -metallisches Element handelt, müssen seine Atome kovalente Bindungen bilden, bis das Octeto de Valencia abgeschlossen ist. Stickstoff erreicht es, wenn es als Datommoleküle n festgelegt ist2, Mit einem dreifachen Verbind.
Gleiches gilt für Phosphor: Zwei seiner P -Atome sind mit einer Dreifachbindung verbunden, um das P -Molekül zu bilden2, Pais; Dies ist der Diphosphor -Alotrope. Phosphor hat jedoch eine größere Atommasse als Stickstoff, und seine 3p -Orbitale, die diffuser als der 2p Stickstoff, überlappen sich mit weniger Effizienz; Daher die p2 Es existiert nur im gasförmigen Zustand.
Stattdessen bevorzugen Atome P bei Raumtemperatur lieber, auf andere Weise kovalent zu organisieren: in einem tetraedrischen Molekül p4:
 P4 -molekulare Einheiten in weißen Phosphorkristallen. Quelle: Benjah-BMM27 über Wikipedia.
P4 -molekulare Einheiten in weißen Phosphorkristallen. Quelle: Benjah-BMM27 über Wikipedia. Beachten Sie, dass alle P -Atome im überlegenen Bild drei einfache Links anstelle eines dreifachen Links haben. Somit Phosphor in p4 Vervollständigen Sie seine Octeto de Valencia. Jedoch in p4 Die P-P-Glieder sind Spannungen vor.
- Alotropes
Weißer Phosphor
Das gleiche Bild der P -Einheiten4 Und seine Instabilität erklärt, warum weißer Phosphor das instabilste Alotrop dieses Elements ist.
Die Einheiten p4 Sie werden im Weltraum geordnet, um einen BCC -Kristall (Phase α) unter normalen Bedingungen zu definieren. Wenn die Temperatur auf -77,95 ° C. Das heißt, die P -Einheiten4 Sie werden in zwei alternativen Schichten, A und B, bestellt, um eine Abab -Sequenz zu etablieren ..
Roter Phosphor
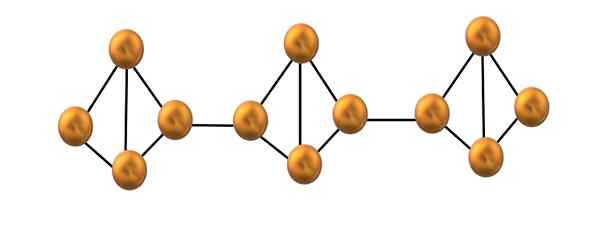 Rote Phosphorkettenstruktur. Quelle: Gabriel Bolívar.
Rote Phosphorkettenstruktur. Quelle: Gabriel Bolívar. Im oberen Bild wird nur ein kleines Segment der roten Phosphorstruktur gezeigt. Da die drei Einheiten "symmetrisch" ausgerichtet sind, kann gesagt werden, dass es sich um eine kristalline Struktur handelt, die durch Erhitzen dieses Phosphors über 250 ° erhalten wird.
Red Phosphor besteht jedoch die meiste Zeit aus einem soliden Amorph, daher ist seine Struktur chaotisch. Also die polymeren Ketten von p4 Sie hätten ohne offensichtliche Muster, eines oben und andere unter derselben Ebene willkürlich.
Beachten Sie, dass dies der Hauptstrukturunterschied zwischen weißem und rotem Phosphor ist: im ersten4 Sie sind individuell und in den zweiten Formketten. Dies ist möglich, weil eine der P-P-Verbindungen im Tetraeder gebrochen ist, um sich mit dem benachbarten Tetraeder zu verbinden. Somit sind die ringförmige Spannung und der rote Phosphor reduzierterer Stabilität verringert.
Kann Ihnen dienen: Zink: Geschichte, Eigenschaften, Struktur, Risiken, verwendetWenn es eine Mischung aus beiden Alotropen gibt, wird sie als gelbes Phosphor in Sichtweite angeboten. Eine Mischung aus Tetraeder und amorphen Phosphorketten. In der Tat weißer Phosphor.
Violett oder Hittorf Phosphor
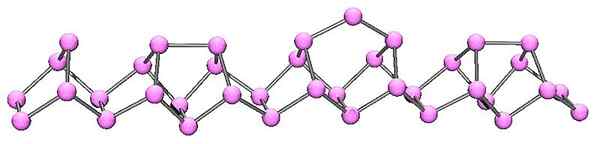 Molekülstruktur des violetten Phosphors. Quelle: Cadmium bei English Wikipedia [Public Domain]
Molekülstruktur des violetten Phosphors. Quelle: Cadmium bei English Wikipedia [Public Domain] Violet Phosphor ist die endgültige Entwicklung des roten Phosphors. Wie im überlegenen Bild zu sehen ist, besteht es weiterhin aus einer polymeren Kette; Aber jetzt sind die Strukturen komplizierter. Es scheint, dass die Struktureinheit nicht mehr die p ist4 aber p2, so angeordnet, dass sie unregelmäßige Pentagonale Ringe bilden.
Trotz der asymmetrischen Struktur gelingt es diesen Polymerketten, genug und regelmäßig so zu bestellen, dass violettes Phosphor.
Schwarzer Phosphor
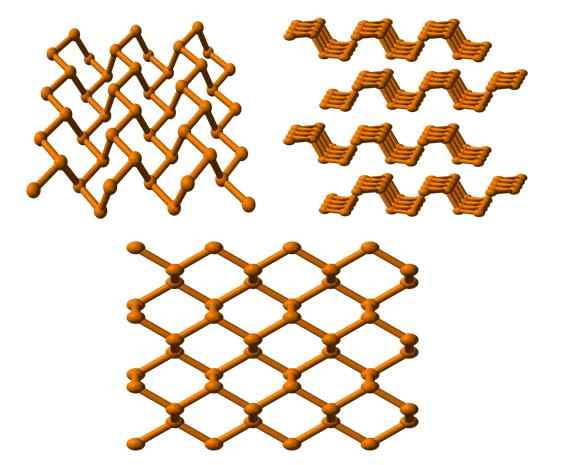 Schwarze Phosphorstruktur aus mehreren Blickwinkeln. Quelle: Benjah-BMM27 [Public Domain].
Schwarze Phosphorstruktur aus mehreren Blickwinkeln. Quelle: Benjah-BMM27 [Public Domain]. Und schließlich haben wir das stabilste Phosphor -Alotrope: die schwarze Farbe. Bereitet den weißen Phosphor unter einem Druck von 12 vor.000 atm.
Im oberen Bild (unten) ist ersichtlich, dass seine Struktur aus einer höheren Ebene eine gewisse Ähnlichkeit mit der von Graphit hat; Es ist ein steiles Netzwerk von sechseckigen Ringen (obwohl sie quadratisch aussehen).
In der oberen linken Ecke des Bildes können Sie den neu kommentierten Kommentar besser zu schätzen wissen. Molekulare Umgebungen von P -Atomen sind trigonale Pyramide. Beachten Sie, dass die Strukturansicht seitlich (obere rechte Ecke) in Schichten angeordnet ist, die auf den anderen passen.
Die Struktur des schwarzen Phosphors ist ziemlich symmetrisch und ordentlich, was mit seiner Fähigkeit zustimmt, sich als ortorrombische Kristalle zu etablieren. Das Stapeln seiner Polymerschichten verursacht P -Atome, die für viele chemische Reaktionen nicht verfügbar sind. Und deshalb ist es erheblich stabil und wenig reaktiv.
Obwohl es nicht notwendig ist, es zu erwähnen, sind die Londoner Dispersionskräfte und die Molmassen dieser phosphorischen Feststoffe diejenigen, die einige ihrer physikalischen Eigenschaften regeln. während ihre Strukturen und Bindungen P-P die chemischen Eigenschaften und andere definieren.
Wo ist es und erhalten
Apatita und Phosphor
Es ist das zwölf Element der Erdkruste und repräsentiert 0,1% davon nach Gewicht. Es gibt ungefähr 550 Mineralien, die Phosphor enthalten, wobei die Apatita das wichtigste Mineral ist, um Phosphor zu erhalten.
Apatita ist ein Phosphor- und Calciummineral, das variable Mengen an Fluorid, Chlorid und Hydroxid enthalten kann, deren Formel wie folgt lautet: [CA10(Po4)6(F, cl oder oh)2)]. Zusätzlich zum Apatit gibt es andere Phosphormineralien von kommerzieller Bedeutung; Dies ist der Fall von Wavelita und Vivianita.
Phosphat- oder Phosphoritgestein ist die Hauptphosphorquelle. Es ist ein nicht-detritischer Sedimentgestein mit einem Phosphorgehalt von 15 bis 20%. Phosphor ist normalerweise als CA vorhanden10(Po4)6F2 (fluoroapatita). Es ist auch als Hydroxyapatit vorhanden, wenn auch in geringerem Maße.
Zusätzlich finden Fluoroapatit Teil der magmatischen und metamorphen Gesteine sowie Kalksteine und Schiefer.
Elektrothermische Reduktion von Fluoroapatita
Ausgewählte Phosphatgesteine werden zur Verarbeitung in die Kläranlage übertragen. Anfang.
Dann soll das Produkt des Schleifens der Gesteinsfragmente gesiegt werden, um sie zu brechen. Diese Fraktionen werden mit einem 34% igen Phosphorgehalt wie Phosphorpentoxid (P) ausgewählt2ENTWEDER5).
Weißer Phosphor (p)4) Es wird industriell durch die elektrothermische Reduktion von Fluoroapatit mit Kohlenstoff bei einer Temperatur von 1 erhalten.500 ºC in Gegenwart von Siliziumoxid:
2ca3(Po4)2(s) + 6sio2(s) + 10 c (s) => p4(g) + Casio3(L) + co (g)
Die p4 In einem gasförmigen Zustand wird es nach dem Kondenseln gesammelt und als weißer fester, fester im Wasser gelagert, um zu verhindern, dass sie mit der äußeren Luft reagieren.
Legierungen
Kupfer
Die Phosphorabdeckung wird mit unterschiedlichen Prozentsätzen von Kupfer und Phosphor hergestellt: CU 94 % - P 6 %; Cu 92% - P 8%; CU 85% - P 15% usw. Die Legierung wird als Desoxidationsmittel, Feuchtigkeitsmittel für die Kupferindustrie und auch als Kern in der Aluminiumindustrie verwendet.
Broncine
Sie sind Kupfer-, Phosphor- und Zinnlegierungen mit 0,5 - 11% Phosphor und 0,01 - 0,35% Zinn. Zinn erhöht die Korrosionsresistenz, während Phosphor.
Es wird bei der Ausarbeitung von Federn, Bolzen und im Allgemeinen in Artikeln verwendet, die Müdigkeit, Verschleiß und chemische Korrosion erfordern. Die Verwendung in Schiffen Propellern wird empfohlen.
Kann Ihnen dienen: Cadmium (CD): Geschichte, Eigenschaften, Struktur, verwendetNictelladas
Die bekannteste Legierung ist der Nipzwanzig, Unter Verwendung des phosphorierten Nickels in starken Schweißlegierungen, um seine Resistenz gegen chemische Erosion, Oxidation und hohe Temperaturen zu verbessern.
Die Legierung wird in Gas- und Reaktionsmotorenkomponenten, Galvanoplastik und in der Herstellung von Schweißelektroden verwendet.
Risiken
Weißer Phosphor produziert ernsthafte Hautverbrennungen und ist ein starkes Gift, das in einer Dosis von 50 mg sterblich sein kann. Phosphor hemmt die Zelloxidation und stört das zelluläre Sauerstoffmanagement, was zur Fettdegeneration und zum Tod der Zelle führen kann.
Eine akute Phosphorvergiftung produziert innerhalb der ersten vier Tage nach dem Einlassbauchschmerz, dem Begeisterung, dem Atem mit dem Geruch von Knoblauch, Phosphoreszenz -Erbrechen, Schwitzen, Muskelkrämpfen und sogar einem Schockzustand.
Anschließend manifestiert.
Die offensichtlichste Manifestation einer chronischen Phosphorvergiftung ist die Schädigung der Knochenstruktur des Kiefers.
Bei Patienten mit Nierenversagen wird ein Anstieg der Plasma -Phosphorkonzentration (Hyperphospathie) vorgestellt. Dies führt zu einer abnormalen Ablagerung von Phosphaten in Weichgeweben, was zu einer Gefäßstörung und Herz -Kreislauf -Erkrankungen führen kann.
Anwendungen
Phosphor ist ein wesentliches Element für Pflanzen und Tiere. Es ist einer der drei Hauptnährstoffe von Pflanzen, die für ihren Wachstum und ihren Energiebedarf notwendig sind. Darüber hinaus ist es Teil von Nukleinsäuren, Phospholipiden, Zwischenprodukten von Stoffwechselprozessen usw.
Bei Wirbeltieren ist der Phosphor in Knochen und Zähnen in Form von Hydroxylapatit vorhanden.
- Elementarphosphor
 Eine Schachtel mit Streichhölzern oder "Phosphor". Quelle: pxhere.
Eine Schachtel mit Streichhölzern oder "Phosphor". Quelle: pxhere. Mit Phosphor wird ein chemischer Schmelz hergestellt, der zur Beleuchtung von Mitteilungen auf Aluminium und seinen Legierungen verwendet wird; sowie in kupfer- und phosphoratischer Bronze.
Es wird auch verwendet, um Brandbomben, Granaten, Rauchpumpen und Tracer -Kugeln herzustellen. Roter Phosphor wird zur Ausarbeitung von Sicherheitsübereinstimmungen oder -übereinstimmungen verwendet.
Weißer Phosphor wird zur Ausarbeitung von Organophosphat verwendet. Zusätzlich wird es bei der Herstellung von Phosphorsäure verwendet.
Eine große Menge an produziertem Phosphor wird für die Herstellung von Phosphor -Tetraxid (p) verbrannt4ENTWEDER10), als Pulver oder Feststoff erhalten.
- Verbindungen
Phosphin
Es ist der Rohstoff für die Ausarbeitung mehrerer Phosphorverbindungen. Es fungiert als Dopingmittel für elektronische Komponenten.
Phosphorsäure
Es wird in der Ausarbeitung von Erfrischungsgetränken aufgrund des charakteristischen Geschmacks verwendet, der sie verleiht. Auf Phosphatgesteine wirken, um dihydrogenes Calciumphosphat zu bilden2Po4)2], auch als Superphosphat bekannt, das als Dünger verwendet wird.
Phosphorsäure ist ein Element -Conditioner des Zahnschmelzes, um die Adhäsion der Materialien seiner Restaurierung zu erleichtern. Es wird auch verwendet, gemischt mit Öl, Harnstoff, Bruch, Bitumen und Sand, um den Asphalt zu bilden; Material, das bei der Reparatur von Landkommunikationskanälen verwendet wird.
Organophosphor
Organophosphorverbindungen haben zahlreiche Anwendungen; wie z.
Dihydratdihydrat -Calciumphosphat
Es wird als Dünger, Backpulver, Tierfutter -Additiv und in der Ausarbeitung von Zahnpasten verwendet.
Phosphorpentoxid
Es wird in der chemischen Analyse als Dehydrationsmittel und in der organischen Synthese als Kondensatormittel verwendet. Die Verbindung wird hauptsächlich für die Produktion von Orthophosphorsäure zugewiesen.
Natriumtripolyphosphat
Es wird in Reinigungsmitteln und als Wasserenthärter verwendet, was die Wirkung von Reinigungsmitteln verbessert und die Korrosion der Rohre vermeidet.
Trisodisches Phosphat
Es wird als Reinigungsmittel und Wasserenthärter verwendet.
Natriumphosphate
Dibasic -Natriumphosphat (NA)2HPO4) und monobasisches Natriumphosphat (NAH2Po4) sind die Komponenten eines pH -Schockdämpfersystems, das sogar in Lebewesen wirkt; Unter ihnen Menschen.
Verweise
- Reid Danielle. (2019). Phosphor -Allotrope: Formen, Verwendung & Beispiel. Lernen. Erholt von: Studium.com
- Prof. Robert J. Lancashire. (2014). Vortrag 5c. Struktur der Elemente, setzen Sie P, S und ich fort. Erholt von: Chem.Uwimona.Edu.JM
- Byju. (2019). Phosphorrot. Erholt von: Byjus.com
- Bing Li, Ceng-Ceng Ren, Shu-Feng Zhang et al. (2019). Elektronische strukturelle und optische Eigenschaften von mehrschichtiger blauem Phosphor: Eine Studie im ersten Prinzip. Journal of Nanomaterials, vol. 2019, Artikel -ID 4020762, 8 Seiten. doi.org/10.1155/2019/4020762
- DR. Teig Stewar. (2019). Phosphorelement -Fakten. Chemicool. Erholt von: Chemicoolool.com
- Wikipedia. (2019). Phosphor. Abgerufen von: in.Wikipedia.Org
- Helmestine, Anne Marie, ph.D. (3. Juli 2019). Phosphor -Fakten (Atomzahl 15 oder Elementsymbol p). Erholt von: thoughtco.com
- Linus Pauling Institute. (2019). Phosphor. Erholt von: LPI.Oregonstate.Edu
- Bernardo Fajardo p. & Héctor Lozano V. (S.F.). Nationale Phosphorgesteinsverarbeitung für die Superphosphatproduktion. [PDF]. Erholt von: Bdigital.ein i.Edu.CO
- Die Herausgeber von Enyclopaedia Britannica. (16. November 2018). Phosphorchemischer Element. Encyclopædia Britannica. Erholt von: Britannica.com
- Reade International Corp. (2018). Kupferphosphor (Tasse) Legierung. Erholt von: Reade.com
- KBM Affilips. (27. Dezember 2018). Masterlegierung von Nickelphosphor (NIP). Azom. Erholt von: Azom.com
- Lentech b.V. (2019). Periodentabelle: Phosphor. Erholt von: lentech.com
- Abhijit Naik. (21. Februar 2018). Phosphorgebrauch. Erholt von: Sciencestruck.com
- « Manometrische Druckerklärung, Formeln, Gleichungen, Beispiele
- Trincheras Kultur Herkunft, Merkmale, Religion, Kultur »

