Van der Waals kräftig
- 3406
- 992
- Ivan Pressler
Wir erklären, welche Van der Waals die Kräfte, ihre Eigenschaften, Typen und geben Beispiele in jedem
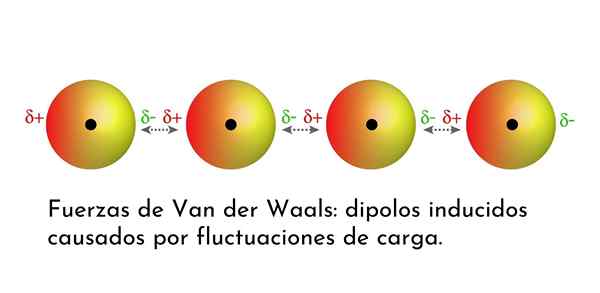
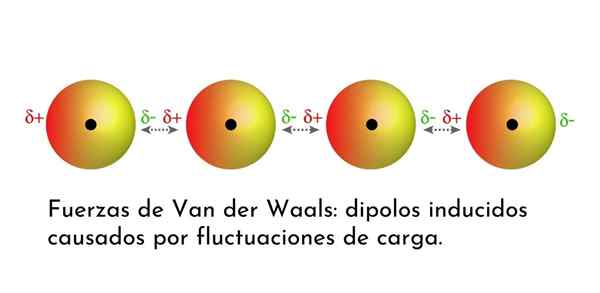 Illustration, die eine der Arten von Kräften von Van der Waals zeigt, Londoner Streitkräfte, unter mehreren Atomen mit sofortigem Dipol
Illustration, die eine der Arten von Kräften von Van der Waals zeigt, Londoner Streitkräfte, unter mehreren Atomen mit sofortigem Dipol Was sind die Streitkräfte von Van der Waals??
Der Van der Waals kräftig Sie sind eine Reihe kurzer Anziehungskräfte zwischen allen Atomen und Molekülen. Sie erhalten ihren Namen zu Ehren des niederländischen Wissenschaftlers Johannes Diderik van der Waals.
Diese Kräfte sind relativ schwach, treten jedoch auf der gesamten Kontaktfläche zwischen zwei Atomen, zwischen zwei Molekülen oder zwischen zwei Oberflächen auf.
Das Verständnis der Kräfte von Van der Waals ermöglicht es qualitativ, viele physikalische Eigenschaften chemischer Substanzen wie ihre Schmelz- und Siedepunkte und Löslichkeit in verschiedenen Arten von Lösungsmitteln vorherzusagen. Dies sind die Kräfte, die erklären, wie es möglich ist, dass ein monoatomisches Gas wie Helium, das keine chemische Bindung bildet, kondensieren und in den flüssigen Zustand wechseln kann.
Diese Kräfte erklären auch, warum eine Substanz wie Wasser, die von Molekülen gebildet wird, deren Molmasse nur 18 g/mol beträgt, flüssig ist, während Chlor, das fast 4 -mal mehr wiegt, ein Gas bei Raumtemperatur ist.
Eigenschaften von Van der Waals Kräfte
Die Kräfte von Van der Waals haben nicht nur eine Art Anziehungskraft zwischen Atomen und Molekülen, sondern auch viele Eigenschaften mit chemischen Bindungen. Als nächstes werden die herausragendsten Merkmale dieser Art von Kräften vorgestellt:
- Sie sind Kräfte, die von der Entfernung abhängig sind. Im einfachsten Fall nehmen sie mit dem Quadrat der Entfernung ab. Zusätzlich hängen sie stark von der molekularen Geometrie ab.
- Im Vergleich zu den Anziehungskräften, die in ionischen, kovalenten und metallischen Verbindungen auftreten, sind die Kräfte von Van der Waals relativ schwach.
- Mit Ausnahme von Dipol-Dipolo-Wechselwirkungen sind sie unabhängige Temperaturwechselwirkungen.
- Sie sind kurze Kräfte, was bedeutet, dass sie schnell abnehmen, wenn sich Atome und Moleküle entfernen.
- Sie sind Generalkräfte, die zwischen einem Atom und jedem Molekül auftreten.
- Im Gegensatz zu kovalenten Bindungen haben sie keine Direktionalität. Dies bedeutet, dass unabhängig von der Orientierung, mit der zwei Moleküle angehen, immer erscheinen, wenn sie sich genug nähern, immer erscheinen Van der Waals.
- Wenn sich zwei Moleküle oder Atome zu stark nähern, wird die Kraft abstoßend, was verhindert, dass die Moleküle sich gegenseitig kollabieren.
- Sie sind additiv, was bedeutet, dass die Existenz vieler gleichzeitiger Wechselwirkungen, obwohl sie erheblich schwach sind.
Arten von Van der Waals Kräfte
Zusätzlich zu der abstoßenden Komponente, die sicherstellt. Diese werden unten dargestellt:
1. Dipolo-Dipolo-Wechselwirkungen oder Keesom-Kräfte
Keesoms Stärke ist einer der Steuerzahler der Kraft von Van der Waals. Dies sind die elektrostatischen Wechselwirkungskräfte, die unter den permanenten Dipole der polaren Moleküle wie Wasser, Aceton und anderer erscheinen.
Die Kräfte von Keesom ähneln den elektrostatischen Kräften zwischen Ionen, unterscheidet sich jedoch darin, dass sie viel schwächer sind und mit der sechsten Distanzkraft zerfallen (dh mit r6). Der Grund, warum sie schwächer sind.
Diese Wechselwirkungen werden nur zwischen Molekülen und nicht zwischen Atomen verabreicht, da Atome keine dauerhaften Dipolmomente aufweisen. Darüber hinaus ist Keesoms Kraft umgekehrt proportional zur Temperatur, was bedeutet, dass die Kraft von Keesom, wenn sie zunimmt.
Beispiele für Moleküle mit Dipol-Dipolo-Wechselwirkungen
Alle polaren Moleküle haben Dipol-Dipol-Wechselwirkungen zwischen ihnen. Zum Beispiel:
- Zwei Acetonmoleküle.
- Zwei Chloroformmoleküle.
- Ein Cyclohexanonmolekül mit einem Acetonmolekül.
2. Induzierte Dipolo-Dipolo-Wechselwirkungen oder Debye-Kräfte
Wenn sich ein polares Molekül einem Atom oder einem apolaren Molekül nähert, zieht der Dipol der ersten Elektronen auf der Oberfläche des zweiten an oder wiederholt sie. Dies induziert ein Dipol im apolaren Molekül, das als induziertes Dipol bezeichnet wird. Der neue Dipol bildete sich und interagiert dann mit dem ursprünglichen Dipol, der eine kleine Anziehungskraft erzeugt.
Kann Ihnen dienen: VerbrennungswärmeDiese Wechselwirkungen zwischen einem dauerhaften und induzierten Dipol werden normalerweise als Debye -Kräfte bezeichnet und hängen nicht nur vom Abstand zwischen den beiden Molekülen oder zwischen dem polaren Molekül und einem individuellen Atom ab, sondern hängen auch von der Polarisierbarkeit des apolarischen Moleküls und der Größe ab und der Größe des Dipolmoments des polaren Moleküls.
Beispiele für Moleküle, die Dipol-Dipol-Wechselwirkungen induziert haben
Diese Art von Wechselwirkungen wird nur zwischen verschiedenen Molekülen verabreicht, da einer polar sein muss und der andere nicht. Einige Beispiele sind:
- Ein Atom eines edlen Gases wie Argon und eine polare Verbindung wie Wasserstoffchlorid. In diesem Fall zieht die positive partielle Belastung des HCl -Wasserstoffs die Valencia -Elektronen von Argon an und erzeugt ein kleines Dipol, das in letzterem induziert ist. Wenn sich ein Argon dem Chloratom nähert, weist die negative partielle Belastung die Valenzelektronen ab und es wird auch ein induzierter Dipol gebildet.
- Die molekulare Bronate (BR2) Es ist im Wasser erheblich löslich, obwohl es eine apolare Verbindung und das Wasser eines stark polaren Lösungsmittels ist. Die Erklärung ist teilweise auf die hohe Polarisierbarkeit des Broms zurückzuführen, die es Ihnen ermöglicht, erheblich starke Wechselwirkungen zu bilden.
3. Induzierte Dipolo-Dipolo-induzierte Wechselwirkungen oder Londoner Dispersionskräfte
Von allen Kräften von Van der Waals sind die schwächsten die Londoner Dispersionskräfte. Diese Wechselwirkungen werden zwischen allen Atomen und Molekülen aufgrund des Auftretens von Instant -Dipolen in einem Teil ihrer Struktur angegeben.
Ein Instant -Dipol ist ein kleiner Dipol, der durch eine asymmetrische Verteilung der Valenzelektronen zu einer bestimmten Zeit gebildet wird.
Kann Ihnen dienen: ungesättigte KohlenwasserstoffeWie werden sofortige Dipole erzeugt??
Da sich die Elektronen um den Kern drehen, kann es passieren, dass es zu einer Zeit mehr Elektronen auf der einen Seite gibt als von der anderen, was zu einem Dipol führt. Dieser kleine Dipol verschwindet schnell, während sich die Elektronen weiter im Kern bewegen, und deshalb werden sie Snapshots genannt.
Sofortige Dipole können überall in der Struktur eines Moleküls auftreten und zu einem bestimmten Zeitpunkt kann es viele von ihnen geben. Die Londoner Dispersionskräfte bestehen aus der Wechselwirkung zwischen diesen sofortigen Zeiten in einem Molekül und denen eines anderen.
Beispiele für Verbindungen mit Londoner Dispersionskräften
Wie bereits erwähnt, treten diese Arten von Wechselwirkungen zwischen allen Atomen und Molekülen auf. Es ist jedoch in den großen apolaren Molekülen, wo seine Wirkung besser beobachtet werden kann, da es in diesen Fällen die einzige Art der intermolekularen Wechselwirkung ist, die auftritt.
Ein typisches Beispiel, bei dem diese Kräfte sehr intensiv sind.

