Intermolekularen Kräfte
- 3907
- 556
- Ivan Pressler
 Schema intermolekularer Kräftetypen
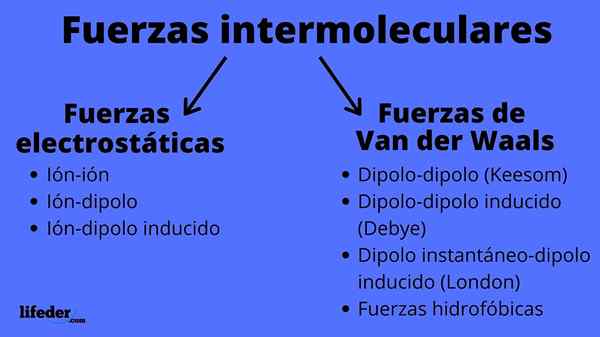
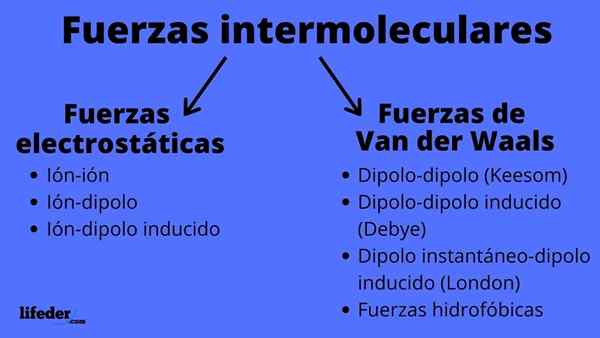
Schema intermolekularer Kräftetypen Was sind intermolekulare Kräfte?
Der Intermolekularen Kräfte Sie sind eine Reihe von Wechselwirkungen, die zwischen den Molekülen stattfinden, ob derselben chemischen Verbindung oder nicht, und die sie zusammenhalten. Dank dieser Kräfte schaffen es die Moleküle, ein festes, flüssiges oder Gas zu gruppieren und zu definieren. Das heißt, sie sind für die physikalischen Eigenschaften von Substanzen verantwortlich.
Intermolekulare Kräfte können zwei Arten sein: elektrostatische oder van der Waals. Die elektrostatischen sind alle, bei denen wir Ionen haben, die elektrisch beladene Atome oder Moleküle sind (+ oder -). In der Zwischenzeit beinhalten die von Van der Waals neutrale Atome oder Moleküle, die durch Schwankungen in ihrer elektronischen Verteilung polarisiert und angezogen oder miteinander abgewiesen werden.
Intermolekulare Kräfte können mit der vorhandenen Vereinigung zwischen verschiedenen Laienstücken verglichen werden. Abhängig von ihren Formen und Richtlinien werden ihre Gewerkschaften schwacher oder schwächer, so wie sie das Design und die endgültigen Dimensionen der Konstruktion verändern.
Je stärker diese Kräfte sind, desto schwieriger wird es, die Laienstücke zu trennen, oder im Fall der Chemie die Moleküle. Dies bedeutet auch, dass es eine größere Verdichtung geben wird und dass die Moleküle daher viskose Flüssigkeiten, schwerere oder dichtere Gase definieren.
Andere physikalische Eigenschaften wie Fusion und Siedepunkte, Volatilität, Textur usw., Sie sind auch makroskopische Reflexe der intermolekularen Kräfte, die zwischen den Molekülen oder Ionen einer Verbindung oder Gemischen bestimmen. Zum Beispiel: Die intermolekularen Kräfte der Gase sind im Vergleich zu einem Stein sehr schwach.
Das Verständnis der intermolekularen Kräfte ist wichtig, um viele der chemischen, physikalischen und biologischen Konzepte zu beschreiben.
Elektrostatische Kräfte
Ionen-Ionen
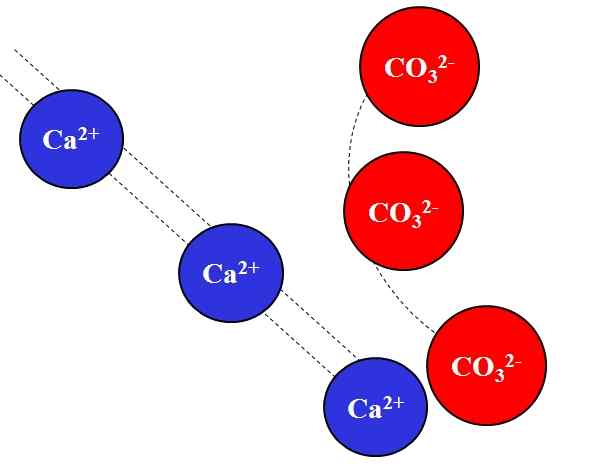 Elektrostatische Anziehungskraft zwischen Ca2+ und CO32 -Ionen-. Quelle: Gabriel Bolívar.
Elektrostatische Anziehungskraft zwischen Ca2+ und CO32 -Ionen-. Quelle: Gabriel Bolívar. Gegenbekämpfte Ionen ziehen mit großer Kraft an, was auf das Gesetz von Coulomb zurückzuführen ist, und verringert schnell, je mehr die Ionen weggehen.
Zum Beispiel das Ca -Ion2+ Es ist eine positive Ladung, ein Kation, während der CO32- Es ist ein negatives Lastion, ein Anion. Ihre entgegengesetzten Ladungen sein, ca2+ und co32- Sie ziehen sich an, um zu beweisen, dass je näher sie sind, desto mehr gemeinsam werden sie bleiben.
Im Gegenteil, Ionen mit derselben Belastung, ob positiv oder negativ, wehren sich mit derselben Kraft, aber im gegenteiligen Sinne. So die ca2+ Abwickeln von Ionen wie Na+, Mg2+, K+, usw., Es sei denn, es gibt andere Anionen, die die Abstoßung verringern.
Es kann Ihnen dienen: Dibenzalacetona: Eigenschaften, Reaktionsmechanismus, Anwendungen, RisikenVon allen intermolekularen Kräften ist die des Ionen-Ionen-Typs am einfachsten; Aber gleichzeitig der stärkste von allen. Es ist viel Energie oder Wärme erforderlich, um die Ionen zu trennen.
Ion-Dipolo
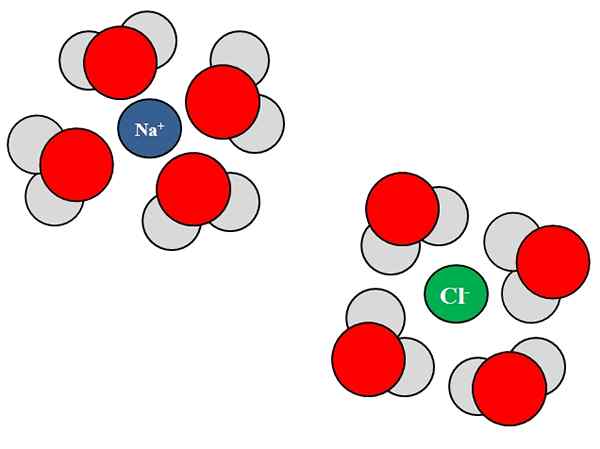 Ionen-Dipolo-Wechselwirkungen zwischen Wassermolekülen und NaCl-Ionen. Quelle: Gabriel Bolívar.
Ionen-Dipolo-Wechselwirkungen zwischen Wassermolekülen und NaCl-Ionen. Quelle: Gabriel Bolívar. Iones können auch mit neutralen Atomen oder Molekülen wie Wasser interagieren. Dies gilt insbesondere dann, wenn es um die Moleküle eines Lösungsmittels geht, das Solvata, das heißt, die Ionen in ihrer Flüssigkeit umgibt.
Zum Beispiel besteht Natriumchlorid, NaCl, aus NA -Ionen+ und Cl-. Wenn ihre Kristalle ins Wasser geworfen werden, die Wassermoleküle, h2O oder hoh, hydratieren oder umgeben die Ionen von NaCl; Aber die Art und Weise, wie sie es tun, variiert je nach dem fraglichen Ion.
So sehen wir im überlegenen Bild, dass das Ion na+ wird durch H H -Sauerstoffatome hydratisiert2ENTWEDER. Inzwischen das Ion CL- wird durch Wasserstoffatome hydratisiert.
Weil? Weil Wasser eine polare Substanz ist, was bedeutet, dass es einen Dipol hat: eine Pole mit einer positiven Teilbelastung und eine andere mit einer negativen Teilbelastung.
Das Sauerstoffatom, weil es elektronegativer ist, zieht die Elektronen zu sich selbst an und lokalisiert so die Elektronen häufiger um dieses Atom. etwas, das mit Wasserstoffatomen nicht dasselbe passiert, weniger elektronegativ. Sauerstoff, weil er negativer ist, ist auf NA ausgerichtet+; Während Wasserstoffe, weil sie positiver sind, sind auf das CL ausgerichtet-, Da entgegengesetzte Gebühren angezogen werden.
Induzierte Ionen-Dipolo
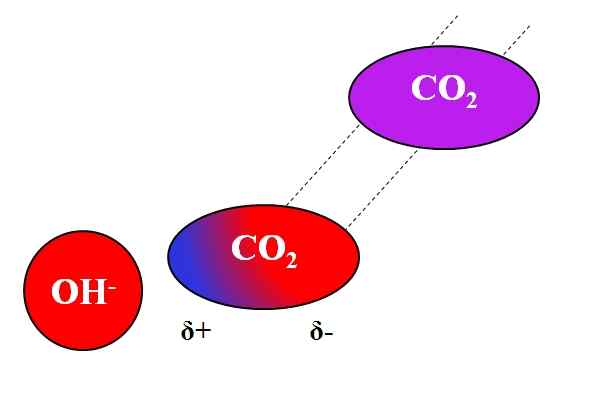 Induktive Wirkung OH- auf das Co₂-Molekül. Quelle: Gabriel Bolívar.
Induktive Wirkung OH- auf das Co₂-Molekül. Quelle: Gabriel Bolívar. Nicht nur polare oder Dipole -Moleküle können mit Ionen interagieren. Bei neutralen Atomen oder Molekülen, selbst wenn sie keine Dipole haben, ist die Verteilung ihrer Elektronen anfällig für die induktiven Effekte nahe gelegener Ionen. Das heißt, die Ionen verursachen eine momentane und kurze Polarisierung, genug für eine bemerkenswerte Interaktion.
Kann Ihnen dienen: Bleiacetat: Struktur, Eigenschaften, erhalten, verwendet, verwendetNehmen Sie zum Beispiel die Wechselwirkung zwischen OH Ion an- und die co2. Die co2 Es ist eine neutrale Verbindung, deren Molekül (in lila) Dipol fehlt. Aber wie sich OH nähert-, Die negative Belastung dieser Repel zu den Elektronen der Sauerstoffatome des CO2.
Je näher die OH sind- und die co2, stärker wird Abstoßung sein. Folglich beginnt ein durch das OH induziertes Dipol festzustellen- Über co2. Ein positiver Pol erscheint Δ+, weil Elektronen abgestoßen, "auswandern" zum anderen Ende des Moleküls.
Also oh- und die co2 Sie bleiben genug zusammen, um miteinander zu reagieren. Dies ist der Grund, warum co2 Es ist besonders löslich in alkalischen Lösungen.
Van der Waals kräftig
Van der Waals 'Kräfte beziehen sich im Prinzip nur auf diejenigen, die zwischen neutralen Atomen oder Molekülen ohne ionische Belastungen bestehen.
Dipolo-Dipolo (Keesom)
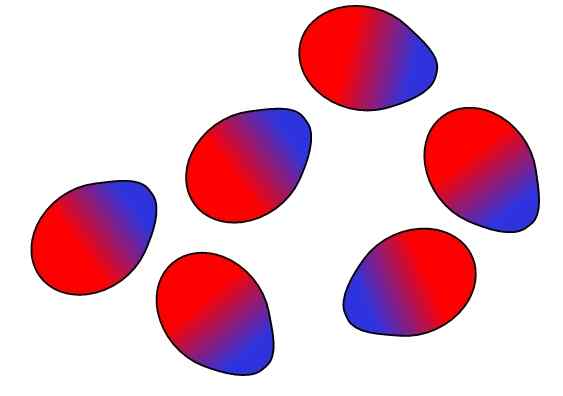 Dipolo-Dipolo-Kräfte. Quelle: Gabriel Bolívar.
Dipolo-Dipolo-Kräfte. Quelle: Gabriel Bolívar. Gegenladungen werden angezogen, gleiche Lasten melden sich ab. Gleiches gilt für die Dipole: Gegen Pole (δ+ und Δ-) werden angezogen, während gleiche Pole sich wehren. Die positiven Pole oder Δ+ werden oben mit der blauen Farbe dargestellt, dass jedoch die negativen Pole oder Δ- mit der roten Farbe dargestellt werden.
Beachten Sie, wie die oberen Moleküle so ausgerichtet und so geordnet sind. Diese Ordnung ist das, was als Wechselwirkungen oder Kräfte Dipolo-Dipolo (Keesom Forces) bekannt ist und die wichtigsten intermolekularen Kräfte zwischen polaren Molekülen sind.
Zum Beispiel H -Moleküle2Oder HCL, HF, CO unter anderem werden sie in ähnlichen Modi bestellt. Je polarer sie sind, desto stärker werden seine Dipol-Dipolo-Kräfte sein; Und daher schwieriger wird es, ihre Moleküle zu trennen.
Die HF ist polarer als die HCl, so dass der Siedepunkt der HF überlegen ist (19.5 ºC) zum HCl (-85).05 ºC). Es ist unglaublich, dass die intermolekularen Kräfte auf physikalische Eigenschaften haben. Die kleinste Variation und die Substanz werden sich völlig anders verhalten als erwartet, was erwartet wurde.
Kann Ihnen dienen: gasöser Zustand: Merkmale, allgemeines Recht, BeispieleInduziertes Dipolo-Dipolo (Debye)
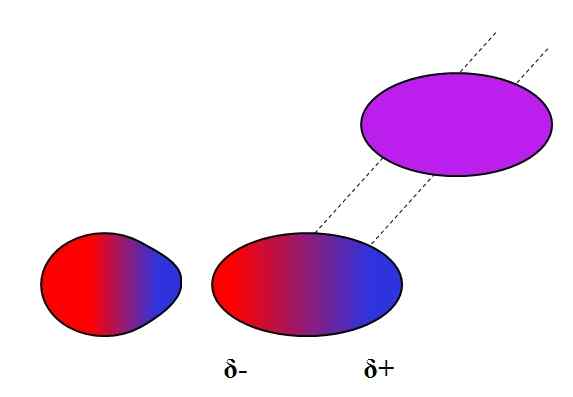 Induziertes Dipolo-Dipolo. Quelle: Gabriel Bolívar.
Induziertes Dipolo-Dipolo. Quelle: Gabriel Bolívar. Dipolos können wie Ionen auch die elektronische Verteilung von neutralen Atomen oder Molekülen schwanken oder beeinflussen. So sehen wir im überlegenen Bild, dass ein Dipol plötzlich ein neutrales Molekül polarisiert. Es wird daher gesagt, dass es sich um eine induzierte Dipol-Dipol-Kraft handelt, da der zweite Dipol momentan ist, nicht dauerhaft.
Zum Beispiel kann Wasser eine kleine Menge von oder auflösen2, Aber genug für Marine Fauna zum Atmen. Wenn h2Oder konnten keinen Dipol in der O induzieren2, Der gesamte Sauerstoff der Meere würde der Oberfläche entkommen, da es keine Wechselwirkungen zwischen beiden Molekülen geben würde.
Sofortiges Dipolo-induziertes Dipolo (London)
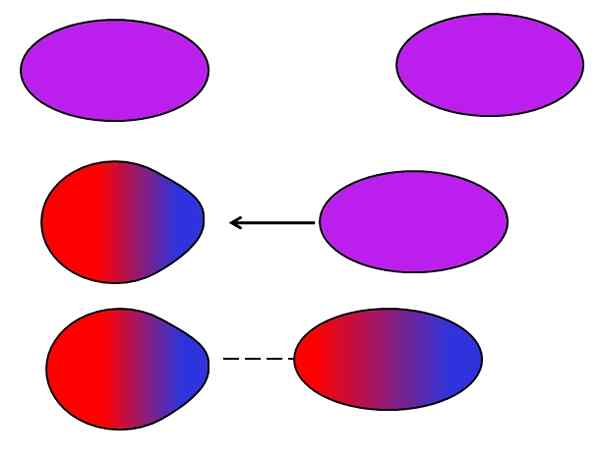 Londoner Streitkräfte. Quelle: Gabriel Bolívar.
Londoner Streitkräfte. Quelle: Gabriel Bolívar. Neutrale Atome oder Moleküle benötigen keine benachbarten Ionen oder Dipole, um für sich selbst Schwankungen bei der Verteilung ihrer inneren Lasten zu leiden. Die Elektronen sind noch nicht still, sondern bewegen sich im gesamten Molekül. Irgendwann findet ein sofortiger Dipol statt, der, wenn es sehr nahe an einem neutralen Molekül oder Atom liegt, einen Dipol in ihnen induziert (siehe oben).
Je größer und asymmetrisch diese Moleküle, desto wahrscheinlicher werden die Instant -Dipole auftreten. Deshalb haben die Verbindungen der höchsten Atommassen einen induzierten sofortigen Dipol-Kräfte-induzierteren intensiver. Diese Art von Van der Waals -Kräften ist besser bekannt als Londoner Streitkräfte.
Zum Beispiel edle Gase (er, NE, AR usw.) Sie bleiben dank der Londoner Streitkräfte vereint, genau wie Luftgase (oder2, N2, CO2, usw.). Auch diese Kraft ist die am meisten vorherrschendste unter Kohlenwasserstoffen wie Methan, Cho4, Und Propan, Cho3CH2CH3.
Hydrophobe Kräfte
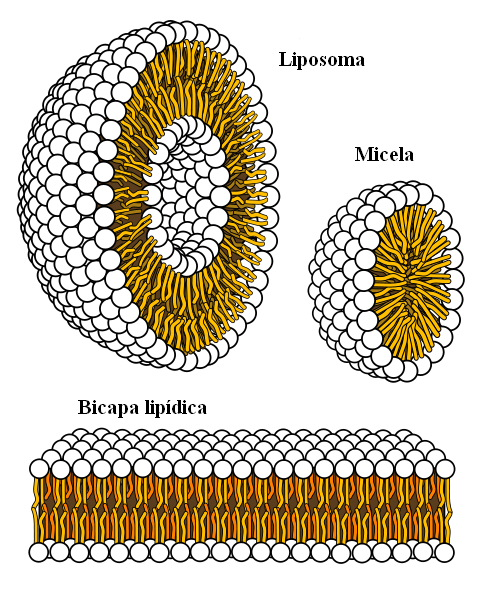 Supramolekulare Strukturen stammen aus hydrophoben Kräften
Supramolekulare Strukturen stammen aus hydrophoben Kräften Schließlich haben wir hydrophobe Kräfte, die ein besonderes Ergebnis von Londoner Kräften und Abstoßungen zwischen Substanzen mit unterschiedlichen Polaritäten sind. Fette sind wenig mit Wasser zusammenhängen.
Fettmoleküle versuchen, so zu gruppieren, dass ihre Wechselwirkungen mit Wasser so weit wie möglich sind, und dies schafft es, 3D -Strukturen zu bilden, wie die oben gezeigten.
So werden Fettmoleküle wie Phospholipide zusammenkommen, um Lipiddoppelschichten, Mizellen und Liposomen zu bilden.
Wenn dies beobachtet wird, haben diese Moleküle einen weißen Kopf, der einen polaren Teil darstellt, der sich auf Wasser bezieht; sowie ein apolarer Schwanz, der die Wassermoleküle abwehrt. Die Linien versuchen, sich in diese supramolekularen Strukturen zu stellen, damit sie nicht mit Wasser interagieren.

