Galvanoplastik

- 4929
- 700
- Ivan Pressler
Wir erklären, womit Galvanoplastik besteht, auch als Elektrodeposition bezeichnet, wie sein Prozess, praktische Beispiele und ihre Anwendungen ist.
 Galvanoplastik eines Löffels
Galvanoplastik eines Löffels Was ist Galvanoplastik?
Galvanoplastik oder Elektrodeposition ist eine elektrochemische Technik, die, wie der Name schon sagt, bei der Ablagerung von Metallenschichten auf Empfangsobjekten besteht. Das heißt, sie von einer Metallabdeckung abzudecken, deren Dicke zwischen 5 und 20 μm liegt.
Diese Technik ist auch als Electrochapado oder Elektrolytik. Wenn wir also ein Kupfer plattiert (Kupfer) wollen, benötigen wir kupferlösliche Salze wie Kupfersulfat, die in Wasser gelöst sind.
Die vorherige Argumentation gilt für jedes andere Metall: Ein gold elektrolytisch plattierter markiert Goldsalze, normalerweise Goldcyanide, die sehr giftig werden können. Somit können einige Objekte wie Esszusammenstoffe mit Gold beschichtet werden, um mehr Wert und Adel zuzuweisen.
Aber die Galvanoplastik geht über die Ästhetik hinaus: Sie werden verliehen. Es ermöglicht auch das Einsparen natürlicher Ressourcen, da es nicht erforderlich ist, große Mengen Metall für Beschichtungen auszugeben.
Galvanoplastikprozess
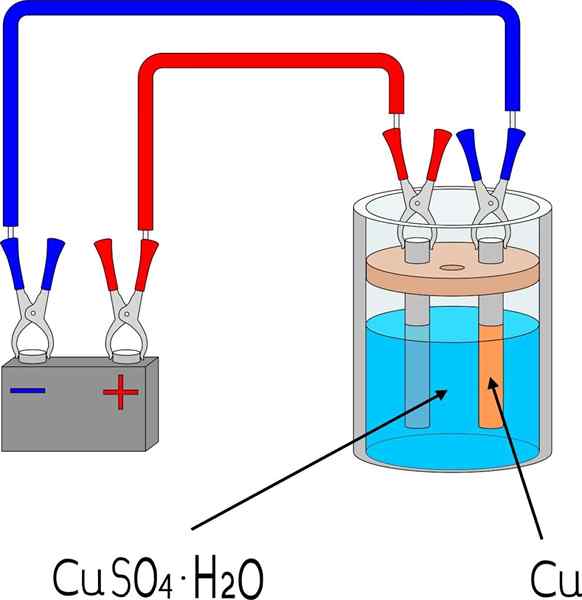 Kupferelektrodeposition in einem Kupfersulfat -Badezimmer
Kupferelektrodeposition in einem Kupfersulfat -Badezimmer Artikel
Um ein Metall auf einer Oberfläche zu elektrodepose.
Im oberen Bild wird beispielsweise eine kleine Kupferelektrode angezeigt, die in jedem Labor oder Raum reproduzierbar ist.
Elektrolytisches Medium
Erstens wird ein Elektrolytmedium des Metalls zu Electrodeposit benötigt. Kupfersulfatsalz, Cuo4, Es ist sehr löslich im Wasser, also bringt es Ionen Cu2+ die dann auf Atome Cu reduziert werden0. Diese Atome sind diejenigen, die auf der Empfangsfläche zusammengesetzt werden, um Metallkristalle hervorzurufen.
Das elektrolytische Medium ist für die Arbeit der Schaltung unverzichtbar, und ionische Belastungen können sich in den Bereich bewegen oder mobilisieren, in dem eine Elektroposition auftritt.
Elektroden
Die Elektroden sind die Oberflächen, auf denen die Elektrodeposition von ihrer chemischen Basis stattfindet. In einfachen Worten gibt es zwei Elektroden: die Kathode, in der das Metall Electrodepos ist; Und die Anode, in der eine chemische Reaktion stattfindet, die Elektronen an die Metallionen spendet, die die Kathode bedecken.
Es kann Ihnen dienen: Urethan: Struktur, Eigenschaften, erhalten, verwendet, verwendetDas heißt, die Kathode wird zu dem Stück, das gewünscht wird. In der Zwischenzeit ist die Anode jede Oberfläche, auf der eine Spezies ihre Elektronen oxidiert und an die Kathode spendet. Oft besteht die Anode aus dem gleichen Metall, das in der elektrolytischen Umgebung gelöst ist. Wenn es in der Mitte kupferisch ist, ist die Anode in diesem Fall metallisches Kupfer.
Externe Schaltung
Die externe Schaltung ist eine Batterie, die die anfänglichen Elektronen liefert, die die Elektrodeposition fördern. Sein Vorhandensein bedeutet, dass die Reaktion nicht spontan ist.
Elektrodenreinigung
Das zu bedeckte Stück muss vollständig sauber sein. Andernfalls ist die plattierte oder Beschichtung defekt.
Da. Eine Möglichkeit, dies nach dem chemischen Waschen zu gewährleisten, besteht darin, das Stück mit Wasser zu benetzen, und wenn die Bildung von Wassertropfen oder ein nichtiformer Flüssigkeitsabfall beobachtet wird, bedeutet dies, dass die Elektrode noch nicht sauber ist.
Reaktionen und Bedeutung von Elektronen
Galvanoplastik ist eine Redoxreaktion. Daher: Eine Spezies muss reduziert werden, während die andere oxidiert oder umgekehrt. Im Kupfer haben wir eine Anode aus Kupfer und eine Kathode aus einem Metall -ME (Eisen, Zink, Zinn usw.).
Wenn wir die Batterie einschalten, fließen sie Elektronen in die Kathode, die sich negativ aufladen beginnt.
Die negative Last der Kathode zieht Kationen an an2+ der elektrolytischen Umgebung, die die Reduzierung erfolgt:
Cu2+(Ac) +2e- → Cu (s)
Es kann Ihnen dienen: Maillard ReaktionDie Batterie muss die gespendeten Elektronen wiederherstellen, und auch die Ionen Cu müssen wiederhergestellt werden2+ reduziert, um die Neutralität der elektrolytischen Umgebung aufrechtzuerhalten. Dies ist der Zeitpunkt, an dem die Anode in Funktion geliefert wird: Kupferatome oxidieren:
Cu (s) → Cu2+(Ac) +2e-
Und die freigesetzten Elektronen werden wieder auf die Batterie gerichtet, was sie wiederum in Richtung der Kathode mobilisiert, um die Elektrodeposition fortzusetzen.
Die Anode gewinnt positive Belastung, was die SO -Ionen anzieht42- des elektrolytischen Mediums (siehe Bild noch einmal).
Das heißt, die Reaktionen, die auftreten, sind die Reduktion und Oxidation von Kupfer, dem Metall, das Electrodepos ist:
Cu2+(Ac) +2e- → Cu (s)
Cu (s) → Cu2+(Ac) +2e-
Die Anode von Kupfer verliert den Teig, während die Kathode eines anderen Metalls mit einer feinen Kupferschicht bedeckt ist.
Beispiele für Galvanoplastik
Silber
Metalle können "Elektroplatten" sein, was sie elektrolytisch von einer Silberschicht bedeckt. Dies ist insbesondere in elektronischen Komponenten von Vorteil, die Strom leiten müssen. Silber kann elektrodeposita auf Stahl, Kupfer, Nickel und anderen Metallen sein.
Verzinnt
Der Tinner ist die Elektrodeposition von Zinn. Es ist sehr nützlich bei der Herstellung von Eisendosen, die mit Zinn bedeckt sind, damit sie gegen Korrosion beständig sind, und so die Lebensmittel oder Produkte, die aufbewahren, nicht beschädigen.
Latein oder braun
Obwohl Messing und Bronze etwas aufwändiger sind, können sie auch in einigen Metallen Elektropos sein, um ihr Aussehen zu verbessern.
Zincado
Zink- oder Zink -Galvanoplastik (nicht verwirrend mit thermischen verzinkt. Somit ist seine Funktion ästhetisch und gleichzeitig funktionsfähig und findet sich in Körperteilen wie den Rädern.
Metallkunststoffe
Kunststoff, die zuvor als leitfähige Oberfläche behandelt wurde, kann auch mit Metall bedeckt sein.
Kann Sie dienen: Kitasato -FlascheGalvanoplastik -Anwendungen
Galvanoplastik- oder Elektrokörperanwendungen können in funktional oder ästhetisch unterteilt werden.
Funktional
 Eine dünne elektrodepos Gold in den Zuschauern der Fälle von Astronauten ermöglicht es ihnen, ihre Augen vor Sonnenlicht zu schützen
Eine dünne elektrodepos Gold in den Zuschauern der Fälle von Astronauten ermöglicht es ihnen, ihre Augen vor Sonnenlicht zu schützen Das Beschichten eines Stücks oder Objekt. Zum Beispiel macht Kupfer- oder Goldelektroden die Teile, die sie haben.
Gold dagegen schützt Wärme- und Strahlungsflächen. Aus diesem Grund wird es in den Satelliten und in den Helmen der Astronauten weit verbreitet, da es das Sonnenlicht widerspiegelt, so.
Chrom- oder Schnickstähle sind sehr resistent gegen Korrosion dank dieser Metallschichten. Deshalb wird in der Branche die Galvanoplastik verwendet, um Metalle zu schützen, die für Corrod empfindlich sind.
Ästhetik
Metallische Furniere glänzen. Zink, Nickel und Chrom werden für diesen Zweck häufig verwendet. Außerdem sind Gold und Silber Elektropos in Ringen, Ketten, Armbändern, Halshängen, Hängen usw., Und daher findet seine Galvanoplastik viele Anwendungen in Juweliergeschäften und -verzierungen, um das Bild und das Prestige dieser Kleidungsstücke zu verbessern.
Verweise
- Shiver & Atkins. (2008). Anorganische Chemie. (Vierte Edition). Mc Graw Hill.
- Whitten, Davis, Peck & Stanley. (2008). Chemie. (8. Aufl.). Cengage Lernen.
- Wikipedia. (2021). Elektroplierend. Abgerufen von: in.Wikipedia.Org
- Chris Woodford. (28. Juli 2020). Wie Elektroplate funktioniert. Abgerufen von: Ermittlung.com
- Rob Snyder. (S.F.). Nanoskalige Elektrodeposition. STEM Education Institute. [PDF]. Erholt von: Nanoskala.UNL.Edu
- Elsevier b.V. (2021). Elektrodeposition. Scientedirect. Abgerufen von: Scientedirect.com
- Vaishali Mittal. (10. Dezember 2020). Elektroplierend. Chemistry Librettexts. Erholt von: Chem.Librettexts.Org
- Singh Davneet. (9. Juni 2020). Verschiedene Arten von Elektropeln. Erholt von: Teachoo.com
- Helmestine, Anne Marie, ph.D. (26. August 2020). Was ist elektroplierend und wie funktioniert es?? Erholt von: thoughtco.com

