Gaseneigenschaften, Verhalten, Form, Beispiele

- 4100
- 1019
- Ibrahim Steuk
Der Gase Sie sind all diese Substanzen oder Verbindungen, deren Aggregationszustände schwach und dispergiert sind, während sie stark von den Druck- und Temperaturbedingungen abhängen, die sie regeln. Vielleicht bilden Sie die zweite Form der Materie, die im gesamten Universum nach Plasma vorhandener ist.
Auf der Erde bilden die Gase die Schichten der Atmosphäre, von der Exosphäre bis zur Troposphäre und der Luft, die wir atmen. Obwohl ein Gas unsichtbar ist, wenn es durch große Räume wie den Himmel verbreitet wird, wird es durch die Bewegung der Wolken, die Wendungen der Klingen einer Mühle oder durch die ausgeatmten Dämpfe unseres Mundes in kalten Klimazonen erkannt.
 Gase können in industriellen oder heimischen Schornsteinen sowie in Rauchtürmen beobachtet werden, die von Vulkanen ausgehen. Quelle: pxhere.
Gase können in industriellen oder heimischen Schornsteinen sowie in Rauchtürmen beobachtet werden, die von Vulkanen ausgehen. Quelle: pxhere. Ebenso wird es in den schwarzen Rauch der Auspuffrohre der Fahrzeuge, in den Rauchsäulen der Türme in den Fabriken oder in dem Rauch, der beim Brennen eines Waldes aufgewachsen ist.
Es ist auch mit gasförmigen Phänomen.
Wo immer die Gase beobachtet werden, bedeutet dies, dass es eine chemische Reaktion gab, es sei denn. Mit zunehmender Temperaturen wird jede Substanz (chemische Elemente) in Gase umgewandelt, einschließlich Metalle wie Eisen, Gold und Silber.
Unabhängig von der chemischen Natur von Gasen teilt jeder gemeinsam die große Entfernung, die seine Partikel trennt (Atome, Moleküle, Ionen usw.), die sich chaotisch und willkürlich durch einen bestimmten Volumen oder Raum bewegen.
[TOC]
Gaseigenschaften
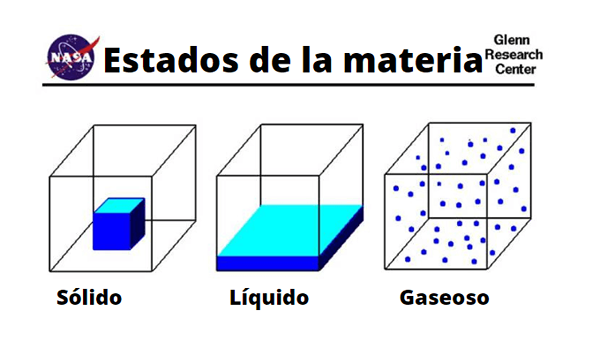 Unterschiede in festen, flüssigen und Gasmolekülen
Unterschiede in festen, flüssigen und Gasmolekülen Physisch
Die physikalischen Eigenschaften von Gasen variieren je nach Substanz oder Verbindung. Im Volksmund sind die Gase aufgrund ihres Schwefelgehalts oder mit dem Vorhandensein von flüchtigen Aminen mit schlechten Gerüchen oder Fäulnis verbunden. Ebenso werden sie durch grüne, braune oder gelbliche Farben sichtbar gemacht, die ein schlechtes Omen einschüchtern und geben.
Die meisten oder zumindest die am häufigsten am häufigsten am häufigsten farblosen und geruchslosen Gase. Auch wenn sie nicht zusammen sind, können sie auf der Haut spüren und sich gegen den Bewegungsbeständigkeit widersetzen, wobei sogar viskose Schichten in den Körpern erzeugt werden, die sie überqueren (wie bei den Flugzeugen).
Alle Gase können Druck- oder Temperaturänderungen aufweisen, die ihre jeweiligen Flüssigkeiten herstellen. Das heißt, sie leiden Kondensation (wenn sie abgekühlt sind) oder verflüssigt (wenn sie "gedrückt" werden).
 Kondensation; des gasförmigen Zustands zum flüssigen Zustand
Kondensation; des gasförmigen Zustands zum flüssigen Zustand Auf der anderen Seite können Gase in Flüssigkeiten und einigen porösen Feststoffen auflösen (wie z. B. Aktivkohlenstoff). Blasen sind das Ergebnis von Gasclustern, die sich in der Mitte noch nicht aufgelöst haben und auf die flüssige Oberfläche fliehen.
Elektrische und thermische Leitfähigkeit
Unter normalen Bedingungen (ohne Ionisierung ihrer Partikel) sind Gase schlechte Wärme- und Elektrizitätstreiber. Wenn sie jedoch mit vielen Elektronen angespannt sind, lassen sie den Durchgang des Stroms durch sie, wie in den Strahlen während der Stürme zu sehen ist.
Andererseits werden bei niedrigen Drücken und einem elektrischen Feld einige Gase, insbesondere das edle oder perfekte, beleuchtete und ihre Lichter für das Design von Nachtleben und Plakaten (Neonlicht) sowie im berühmten elektrischen Schock verwendet Lampen auf Straßenlaternen.
Kann Ihnen dienen: Granataria -Gleichgewicht: Merkmale, Teile und wie man sie benutztIn Bezug auf die thermische Leitfähigkeit verhalten sich viele Gase als thermische Isolatoren, so dass ihre Einbeziehung in die Füllung von Fasern, Geweben oder Glastafeln verhindert, dass Wärme sie brauen und die Temperatur konstant hält.
Es gibt jedoch Gase, die gute Wärmeleiter sind und schlechtere Verbrennungen verursachen können, die durch Flüssigkeiten oder Feststoffe verursacht werden. Zum Beispiel wie beim heißen Dampf von gebackenen Kuchen (oder Empanadas) oder mit Dampfjets, die den Kesseln entkommen.
Reaktivität
Im Allgemeinen werden die Reaktionen mit Gasen oder wo sie auftreten, als gefährlich und umständlich beschrieben.
Seine Reaktivität hängt wiederum von ihrer chemischen Natur ab; Bei starker Erweiterung und Mobilisierung muss jedoch mehr Sorgfalt und Kontrolle erfasst werden, da sie drastische Druckerhöhungen auslösen können, die die Struktur des Reaktors in Gefahr bringen; Ganz zu schweigen davon, wie brennbar oder keine glücklichen Gase sind.
Gase -Verhalten
Makroskopisch kann man eine Vorstellung vom Verhalten von Gasen geben, indem man beobachtet, wie sich Rauch, Ringe oder literarische "Sprachen" von Zigaretten in der Luft entwickeln. Wenn eine Rauchgranate explodiert, ist es interessant, die Bewegung dieser Wolken verschiedener Farben zu detaillieren.

Solche Beobachtungen unterliegen jedoch der Luftwirkung und auch der Tatsache, dass sehr feine feste Partikel in Rauch aufgehängt sind. Daher reichen diese Beispiele nicht aus, um eine Schlussfolgerung bezüglich des wahren Verhaltens eines Gases zu ziehen. Stattdessen wurden Experimente durchgeführt und entwickelten die kinetische Theorie von Gasen.
Molekular und idealerweise kollidieren gasförmige Partikel elastisch miteinander, mit linearen, rotationalen und Schwingungsverschiebungen. Sie haben eine durchschnittliche damit verbundene Energie, die es ihm ermöglicht, sich frei durch jeden Raum zu bewegen, ohne fast zu interagieren oder mit einem anderen Teilchen zu kollidieren, wenn das Volumen um sie herum zunimmt.
Sein Verhalten wäre eine Mischung aus der Brownschen unregelmäßigen Bewegung und der Kollisionen von Billardkugeln, die sich ununterbrochen aufeinander und die Wände des Tisches abspringen. Wenn es keine Wände gibt, breiten sie sich in Richtung Unendlichkeit aus, es sei denn, sie behalten sie: Schwerkraft.
Gasenform
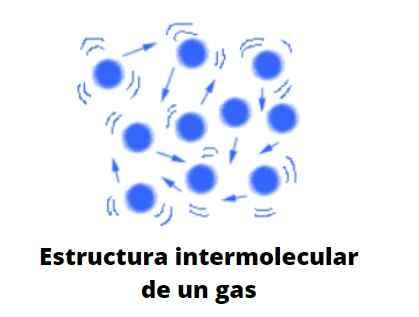
Gase unterliegen im Gegensatz zu Flüssigkeiten und Feststoffen nicht dem kondensierten Typ; Das heißt. Sie teilen mit Flüssigkeiten die Tatsache, dass sie das Volumen des Behälters, der sie enthält, vollständig belegen; Es fehlt ihnen jedoch Oberflächen- und Oberflächenspannungen.
Wenn die Gaskonzentration hoch ist, können Ihre bereits beschriebenen "Sprachen" oder makroskopische Formen mit dem bloßen Auge sichtbar gemacht werden. Diese früher oder später werden aufgrund der Wirkung des Windes oder durch die bloße Erweiterung des Gases verblassen. Gase decken daher alle Ecken des begrenzten Raums ab und verursachen hoch homogene Systeme.
Jetzt betrachtet die Theorie Gase bequem als Kugeln, die kaum mit sich selbst kollidieren; Aber wenn sie es tun, springen sie elastisch ab.
Diese Kugeln sind sehr voneinander getrennt, sodass die Gase praktisch "voll" Vakuum sind; Von dort aus schulden Sie Ihre Vielseitigkeit, den geringsten Schlitz oder den geringsten Spalt zu überqueren, und die einfache, sie erheblich komprimieren zu können.
Kann Ihnen dienen: nicht -metallische OxideAus diesem Grund ist es sicher, dass das Aroma des frisch gebackenen Brotes genossen wird.
Gasdruck
Es könnte angenommen werden, dass diese durch so verstreute und getrennten Gaskugeln oder -partikel keinen Druck auf Körper oder Objekte erzeugen können. Die Atmosphäre zeigt jedoch, dass ein solcher Glaube falsch ist: Sie hat eine Masse, wiegt und verhindert, dass Flüssigkeiten vor nichts verdampfen oder kocht. Siedepunkte werden bei atmosphärischem Druck gemessen.
GASE -Drücke werden quantifizierbarer, wenn Manometer verfügbar sind oder wenn sie von nicht verformbaren Wandbehältern gesperrt sind. Je mehr Gaspartikel sich im Behälter befinden, desto größer ist die Anzahl der Kollisionen zwischen ihnen und den von denselben Wänden.
Diese Partikel beim Kollieren mit den Wänden drücken sie, während sie auf ihrer Oberfläche eine Kraft proportional zu ihrer kinetischen Energie ausüben. Es ist, als ob die idealen Billardkugeln an einer Wand überwältigt wären; Wenn es viele gibt, die sie mit hoher Geschwindigkeit beeinflussen, könnte es brechen.
Einheiten
Es gibt viele Einheiten, die die Druckmessungen eines Gases begleiten. Einige der bekanntesten sind die Millimeter von Quecksilber (MMHG) sowie der Torr. Sind die des internationalen Systems der Einheiten (SI), die das Pascal (PA) in Bezug auf N/M definieren2; Und von ihm, den Kilo (KPA), Mega (MPA) und Giga (GPA) Pascal.
Gasvolumen
Ein Gas besetzt und erweitert sich während des gesamten Volumens des Behälters. Je größer der Behälter ist, ist auch das Gasvolumen; Aber sowohl ihr Druck als auch ihre Dichte nimmt bei der gleichen Partikelnsmenge ab.
Das Gas selbst hat andererseits ein zugehöriges Volumen, das (idealerweise) nicht so stark von seiner molekularen Natur oder Struktur abhängt, sondern von den Druck- und Temperaturbedingungen, die es regeln; Dies ist sein Molvolumen.
In Wirklichkeit variiert das Molvolumen von einem Gas zum anderen, obwohl die Variationen klein sind, wenn sie nicht heterogen und große Moleküle sind. Zum Beispiel das molare Ammoniakvolumen (NH3, 22.079 l/mol) bei 0 ºC und 1 atm unterscheidet es sich von Helium (er, 22.435 l/mol).
Alle Gase haben ein molares Volumen, das sich je nach P und T ändert, und unabhängig davon, wie groß ihre Partikel sind, ist die Anzahl von ihnen immer dieselbe. Von hier aus leitete er das ab, was die Avogadro -Nummer (n) bekannt istZU).
Hauptgesetze von Gasen
Das GASE -Verhalten wird seit Jahrhunderten durch Experimente, tiefe Beobachtungen und Interpretation der Ergebnisse untersucht.
Solche Experimente ermöglichten eine Reihe von Gesetzen, die in derselben Gleichung (der idealen Gase) die Reaktionen eines Gases auf unterschiedliche Druck- und Temperaturbedingungen vorhersagen, dazu beitragen. Auf diese Weise besteht eine Beziehung zwischen Volumen, Temperatur und Druck sowie der Anzahl ihrer Muttermale in einem bestimmten System.
Zu diesen Gesetzen gehören die folgenden vier: Boyle, Charles, Gay-Lussac und Avogadro.
Boyle Law
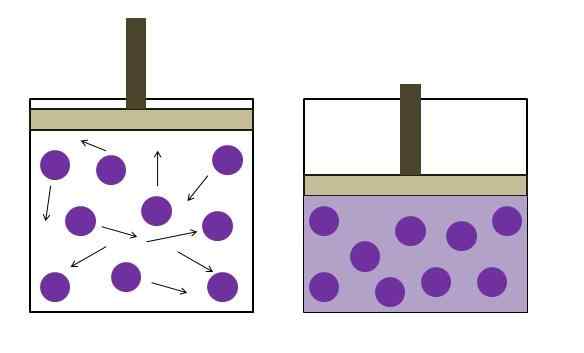 Erhöhter Druckreduzierungsdruck. Quelle: Gabriel Bolívar
Erhöhter Druckreduzierungsdruck. Quelle: Gabriel Bolívar Das Boyle -Gesetz legt fest, dass das Volumen eines idealen Gases bei konstanter Temperatur umgekehrt proportional zu seinem Druck ist. Dies ist, je größer der Behälter ist, desto niedriger ist der Druck, den seine Wände durch die gleiche Menge an Gas erleben werden.
Es kann Ihnen dienen: Charles Law: Formeln und Einheiten, Experiment, ÜbungenCharles Law
 Chinesische Laternen oder Wünsche. Quelle: pxhere.
Chinesische Laternen oder Wünsche. Quelle: pxhere. Charles 'Gesetz stellt fest, dass das Volumen eines idealen Gases bei konstantem Druck direkt proportional zu seiner Temperatur ist. Die Luftballons zeigen Charles '.
Gay-Lussac Law
Das Gay-Lussac-Gesetz legt fest, dass der Druck eines idealen Gases bei konstantem Volumen direkt proportional zu seiner Temperatur ist. In einem gut festgelegten Kessel, wenn sich ein Gas zunehmend erwärmt, ist jedes Mal, wenn der Druck im Inneren größer ist, da die Wände des Kessels nicht verformt oder sich erweitern. Das heißt, sein Volumen ändert sich nicht, es ist konstant.
Avogadro -Gesetz
Schließlich legt das Avogadro -Gesetz fest, dass das von einem idealen Gas besetzte Volumen direkt proportional zur Anzahl seiner Partikel ist. Es ist also, wenn Sie einen Mol Partikel haben (6,02 · 1023), dann wird das molare Gasvolumen sein.
Arten von Gasen
Brennbare Gase
Dies sind Gase, deren Komponenten als Kraftstoffe fungieren, weil sie für die Erzeugung der Wärmeenergie verwendet werden. Einige von ihnen sind Erdgas, Verflüssigöl und Wasserstoffgas.
Industriegase
Es handelt sich. Einige dieser Gase sind Sauerstoff, Stickstoff, Helium, Chlor, Wasserstoff, Kohlenmonoxid, Propan, Methan, Lachgas oxid unter anderem.
Inertgase
Sie sind jene Gase, die unter bestimmten Temperatur- und Druckbedingungen keine chemische Reaktion oder eine sehr niedrige Erzeugung erzeugen. Sie sind das Neon, Argon, Helium, Kripton und Xenon. Sie werden in chemischen Prozessen verwendet, bei denen nicht reaktive Elemente erforderlich sind.
Beispiele für gasförmige Elemente und Verbindungen
Was sind die gasförmigen Elemente des Periodenzüchtertisches unter terrestrischen Bedingungen??
Wir haben zuerst Wasserstoff (H), die H -Moleküle bildet2. Es folgt Helium (er), das leichtere edle Gas; und dann Stickstoff (N), Sauerstoff (O) und Fluorid (F). Diese letzten drei bilden auch Diatommoleküle: n2, ENTWEDER2 und f2.
Nach dem Fluorid kommt das Neon (NE), das edle Gas, das dem Helium folgt. Unter Fluor haben wir Chlor (CL) in Form von CL -Molekülen2.
Dann haben wir den Rest der edlen Gase: Argon (AR), Kripton (KR), Xenón (XE), Radon (RN) und OGANESON (OG).
Daher sind sie insgesamt zwölf gasförmige Elemente; Elf, wenn wir den hoch radioaktiven und instabilen Oganeon ausschließen.
Gasverbindungen
Zusätzlich zu gasförmigen Elementen werden einige gemeinsame gasförmige Verbindungen aufgeführt:
-H2S, Schwefelwasserstoff, verantwortlich für den Geruch von faulen Eiern
-NH3, Ammoniak, dieses durchdringende Aroma, das in gebrauchten Seifen wahrgenommen wird
-CO2, Kohlendioxid, ein Treibhausgas
-NEIN2, Stickstoffdioxid
-Nein, Stickstoffmonoxid, ein Gas, das als äußerst giftig angesehen wurde, aber eine wichtige Rolle im Kreislaufsystem spielt
-SW3, Schwefeltrioxid
-C4H10, Butan
-HCl, Wasserstoffchlorid
-ENTWEDER3, Ozon
-Sf6, Hexafluoruro von Schwefel
Verweise
- Whitten, Davis, Peck & Stanley. (2008). Chemie. (8. Aufl.). Cengage Lernen.
- Die Eigenschaften von Gasen. Abgerufen von: Chemed.Chem.Purdue.Edu
- Wikipedia. (2019). Gas. Abgerufen von: in.Wikipedia.Org
- Helmestine, Anne Marie, ph.D. (5. Dezember 2018). Gase - Allgemeine Eigenschaften von Gasen. Erholt von: thoughtco.com
- Harvard Herren Health Watch. (2019). Der Gaszustand. Erholt von: Gesundheit.Harvard.Edu
- Elektronikkühlungsredakteure. (1. September 1998). Die thermische Leitfähigkeit von Gasen. Wiederhergestellt von: Elektronikkühlung.com
- « Dämonologiegeschichte, welche Studie und berühmte Demonologen
- Graphic neuartige Eigenschaften, Elemente, Beispiele »

