Molekulargeometriekonzept, Typen und Beispiele
- 701
- 0
- Said Ganzmann
Der Molekulargeometrie entweder molekulare Struktur Es ist die räumliche Verteilung von Atomen um ein zentrales Atom. Atome repräsentieren Regionen, in denen eine hohe elektronische Dichte vorliegt, und gelten daher als elektronische Gruppen, unabhängig von den Bildung, die sich bilden (einfach, doppelt oder dreifach).
Die molekulare Geometrie eines Elements kann einige seiner physikalischen oder chemischen Eigenschaften charakterisieren (Siedepunkt, Viskosität, Dichte usw.). Zum Beispiel bestimmt die molekulare Struktur von Wasser ihre Löslichkeit.
 Quelle: Gabriel Bolívar
Quelle: Gabriel Bolívar Dieses Konzept stammt aus der Kombination und experimentellen Daten von zwei Theorien: dem der Valencia Link (TEV) und der Abstoßung der elektronischen Paare der Valencia -Schicht (RPECV). Während der erste die Verbindungen und ihre Winkel definiert, etabliert der zweite die Geometrie und folglich die molekulare Struktur.
Welche geometrischen Formen können Moleküle übernehmen? Die beiden vorherigen Theorien tragen die Antworten bei. Laut RPECV müssen die Atome und Paare freier Elektronen so im Raum angeordnet werden.
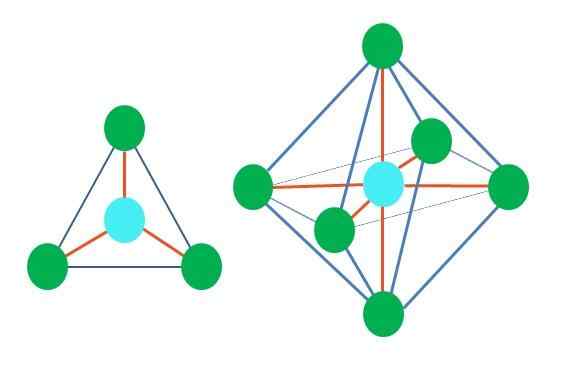
Geometrische Formen sind also nicht willkürlich, sondern suchen Sie das stabilste Design. Zum Beispiel ist im oberen Bild ein Dreieck links und rechts ein Oktaeder zu sehen. Grüne Punkte repräsentieren die Atome und orangefarbenen Streifen die Links.
Im Dreieck sind die drei grünen Punkte in einer Trennung von 120 ° ausgerichtet. Dieser Winkel, der gleich dem der Verbindung entspricht, ermöglicht es Atomen, sich gegenseitig wie möglich abzuwehren. Daher wird ein Molekül mit einem zentralen Atom, das an drei weitere gebunden ist, eine flache trigonale Geometrie annehmen.
Das RPECV sagt jedoch voraus, dass ein Paar freier Elektronen im zentralen Atom die Geometrie verzerren wird. Im Fall der trigonalen Ebene drückt dieses Drehmoment die drei grünen Punkte, was zu einer trigonalen Pyramidengeometrie führt.
Das gleiche kann auch mit dem Oktaeder des Bildes passieren. In all den Atomen werden auf die stabilste Weise getrennt.
[TOC]
Wie man im Voraus die molekulare Geometrie eines Atoms X weiß?
Dafür ist es auch notwendig, freie Elektronen als elektronische Gruppen zu betrachten. Diese werden zusammen mit den Atomen das definieren, was als die genannt wird Elektronische Geometrie, Das ist ein untrennbarer Begleiter der molekularen Geometrie.
Aus der elektronischen Geometrie und nach der Erkennung der Paar freien Elektronen durch Lewis -Struktur kann festgestellt werden, welche molekulare Geometrie aussehen wird. Die Summe aller molekularen Geometrien liefert eine Skizze der globalen Struktur.
Arten der molekularen Geometrie
Wie im Hauptbild zu sehen ist, hängt die molekulare Geometrie davon ab, wie viele Atome das zentrale Atom umgeben. Wenn jedoch ein paar Elektronen ohne Freigabe vorhanden sind, wird die Geometrie geändert, da es viel Volumen einnimmt. Daher übt es einen sterischen Effekt aus.
Danach kann die Geometrie für viele Moleküle eine Reihe charakteristischer Formen darstellen. Und hier entstehen die verschiedenen Arten der molekularen Geometrie oder der molekularen Struktur.
Wann ist die Geometrie gleich der Struktur?? Beide bezeichnen das gleiche nur in Fällen, in denen die Struktur nicht mehr als eine Geometrieart aufweist. Andernfalls müssen alle vorhandenen Typen berücksichtigt werden und der Struktur einen globalen Namen geben (linear, verzweigt, globulär, flach usw.).
Kann Ihnen dienen: HydraceGeometrien sind besonders nützlich, um die Struktur eines Feststoffs aus seinen Struktureinheiten zu erklären.
Linear
Alle kovalenten Bindungen sind richtungsfähig, daher ist der A-B-Glied linear. Wird das Molekül aber linear sein2? Wenn ja, wird die Geometrie einfach dargestellt als: B-A-B. Die beiden B -Atome sind durch einen Winkel von 180 ° getrennt, und gemäß den TEV muss ein hybride SP -Orbitale haben.
Eckig
 Quelle: Gabriel Bolívar
Quelle: Gabriel Bolívar Eine lineare Geometrie für das AB -Molekül kann in erster Instanz angenommen werden2; Es ist jedoch wichtig, Lewis 'Struktur zu ziehen, bevor er eine Schlussfolgerung erzielt. Wenn Sie die Lewis -Struktur gezeichnet haben, können Sie die Anzahl der ungewöhnlichen Elektronenpaare (:) auf dem Atom von a identifizieren.
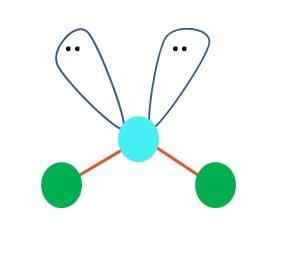
Wenn dies so ist, wechseln die beiden Atome von B auf den Elektronenpaaren und wechseln ihre Winkel. Infolgedessen wird das lineare B-A-B-Molekül zu einem V, einem Bumerang oder einer Winkelgeometrie (überlegenes Bild)
Das Wassermolekül H-O-H ist das ideale Beispiel für diese Art von Geometrie. Im Sauerstoffatom gibt es zwei Elektronenpaare, ohne zu teilen, die in einem ungefähren Winkel von 109º ausgerichtet sind.
Warum dieser Winkel? Weil die elektronische Geometrie tetraedrisch ist, die vier Eckpunkte hat: zwei für H -Atome und zwei für Elektronen. Beachten Sie im überlegenen Bild, dass die grünen Punkte und die beiden "Lappen mit Augen" ein Tetraeder mit dem bläulichen Punkt in seiner Mitte zeichnen.
Wenn die oder keine freien Elektronen hätten, würde das Wasser ein lineares Molekül bilden, seine Polarität würde sich verringern und die Ozeane, Meere, Seen usw. usw., Sie würden wahrscheinlich nicht existieren, wie sie sich kennen.
Tetraedrisch
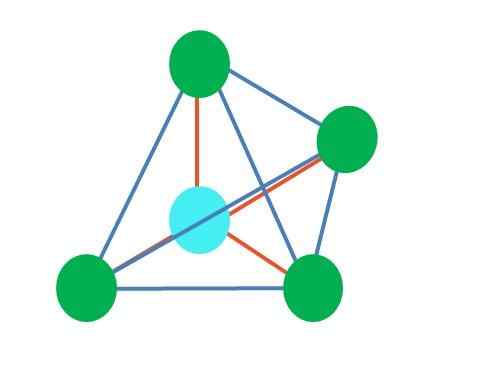 Quelle: Gabriel Bolívar
Quelle: Gabriel Bolívar Das obere Bild repräsentiert die tetraedrische Geometrie. Für das Wassermolekül ist seine elektronische Geometrie tetraedrisch, aber durch Eliminierung elektronenfreier Paare kann es angemerkt werden, dass es in eine Winkelgeometrie umgewandelt wird. Dies wird auch einfach beobachtet, indem zwei grüne Punkte beseitigt werden. Die restlichen beiden zeichnen das V mit dem blauen Punkt.
Was wäre, wenn es anstelle von zwei Paar freien Elektronen nur einen gäbe?? Dann würde es eine trigonale Ebene geben (Hauptbild). Durch die Beseitigung einer elektronischen Gruppe wird jedoch der sterische Effekt, der durch das Paar freier Elektronen erzeugt wird, nicht vermieden. Daher verzerrt es die trigonale Ebene zu einer dreieckigen Basispyramide:
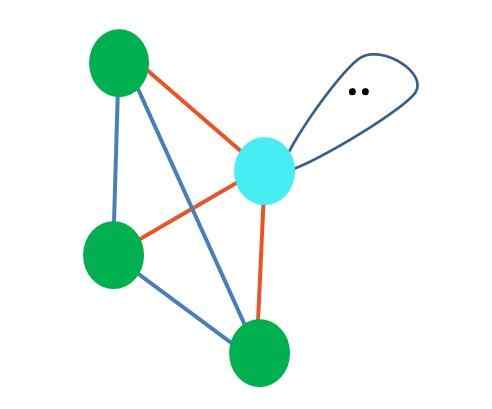 Quelle: Gabriel Bolívar
Quelle: Gabriel Bolívar Obwohl die molekulare Geometrie -trigonale und tetraedrische Pyramide unterschiedlich sind, ist die elektronische Geometrie gleich: Tetraedrisch. Die trigonale Pyramide gilt also nicht als elektronische Geometrie?
Die Antwort lautet Nein.
Aus diesem Grund ist es immer wichtig, die erste elektronische Geometrie mit Hilfe von Lewis -Strukturen zu bestimmen, bevor die molekulare Geometrie definiert wird. Das Ammoniakmolekül NH3, Es ist ein Beispiel für die trigonale Pyramide der molekularen Geometrie, jedoch mit tetraedrischer elektronischer Geometrie.
Trigonale Bipiramid
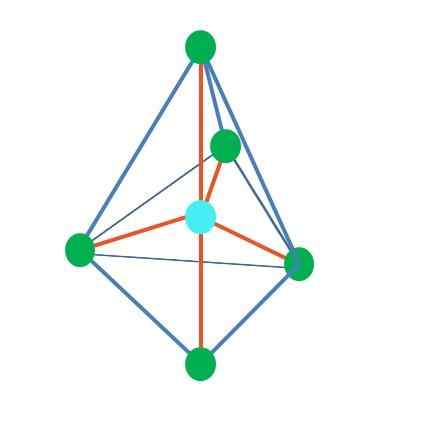 Quelle: Gabriel Bolívar
Quelle: Gabriel Bolívar Bisher haben ihre zentralen Atome mit Ausnahme der linearen Geometrie in tetraedrischen, eckigen und trigonalen Pyramiden spybridisierende SP3, Nach Angaben des TEV. Dies bedeutet, dass wenn seine Verbindungswinkel experimentell bestimmt wurden, sie um 109 ° liegen sollten.
Es kann Ihnen dienen: Angewandte Chemie: Studienobjekt, Zweige, Wichtigkeit, BeispieleAus der trigonalen dipharmidalen Geometrie gibt es fünf elektronische Gruppen rund um das zentrale Atom. Im oberen Bild können Sie mit den fünf grünen Punkten sehen; Drei in der dreieckigen Basis und zwei in axialen Positionen, die die oberen und unteren Eckpunkte der Pyramide sind.
Welche Hybridisierung hat dann den blauen Punkt? Es benötigt fünf hybride Orbitale, um einfache (orange) Bindungen zu formen. Dies erreicht es durch die fünf Orbitale SP3D (Produkt der Mischung eines Orbitals, drei P und eines D).
Bei der Berücksichtigung von fünf elektronischen Gruppen ist die Geometrie bereits freigelegt, aber Elektronenpaare ohne Teilen erleiden sie erneut Verzerrungen, die andere Geometrien erzeugen. Ebenso stellt sich die folgende Frage: Diese Paare können jede Position der Pyramide einnehmen? Diese sind: das Axial oder die Äquatorial.
Axiale und äquatoriale Positionen
Die grünen Punkte, aus denen die dreieckige Basis besteht. Wo bevorzugt das Elektronenpaar ohne Teilen liegt? In dieser Position, die zur maximalen elektrostatischen Abstoßung und der sterischen Wirkung abnimmt.
In axialer Position würde das Elektronenpaar „Druck“ senkrecht (90 °) auf dreieckiger Basis ausführen, während die verbleibenden elektronischen Gruppen der Basi Drei, wie bei der Basis).
Daher wird das zentrale Atom versuchen, seine elektronenfreien Gleichaltrigen in äquatorialen Positionen zu leiten, um stabilere molekulare Geometrien zu erzeugen.
Oszillierend und Form von t
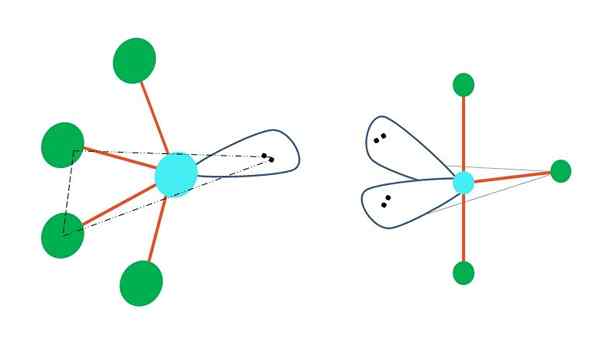 Quelle: Gabriel Bolívar
Quelle: Gabriel Bolívar Wenn eine oder mehrere seiner Atome frei von Elektronen in trigonaler Bipirramidgeometrie ersetzt werden, hätten auch verschiedene molekulare Geometrien.
Links vom oberen Bild ändert sich die Geometrie in der oszillierenden Form. Darin drückt das elektronenfreie Drehmoment den Rest der vier Atome in die gleiche Richtung und biegt ihre Glieder nach links. Beachten Sie, dass dieses Drehmoment und zwei der Atome in derselben dreieckigen Ebene des ursprünglichen Bipiramids liegen.
Und rechts vom Bild die Geometrie in Form von t. Diese molekulare Geometrie ist das Ergebnis des Ersetzens von zwei Atomen durch zwei Elektronenpaare, was führt, was dazu führt.
Also für ein Molekül vom Typ AB5, Dies nimmt die trigonale Bipyramidengeometrie an. AB4, Mit der gleichen elektronischen Geometrie wird es eine oszillierende Geometrie übernehmen; und ab3, T -verdrängte Geometrie. In allen haben (im Allgemeinen) SP -Hybridisierung3D.
Um die molekulare Geometrie zu bestimmen, muss die Lewis -Struktur und damit ihre elektronische Geometrie gezogen werden. Wenn es sich. Somit kann es zwischen den drei möglichen molekularen Geometrien perfekt erkannt werden.
Oktaedrisch
Rechts vom Hauptbild ist die oktaedrische molekulare Geometrie dargestellt. Diese Art von Geometrie entspricht AB -Verbindungen6. Ab4 Sie bilden die quadratische Basis, während die verbleibenden zwei B sich in axialen Positionen positionieren. Somit werden mehrere gleichseitige Dreiecke gebildet, die die Gesichter des Oktaeders sind.
Kann Ihnen dienen: AktivierungsenergieHier kann es wieder (wie in allen elektronischen Geometrien) freie Elektronenpaare geben und daher von dieser Tatsache abgeleitet werden, andere molekulare Geometrien. Zum Beispiel AB5 Mit außertronistischer elektronischer Geometrie besteht es aus einer Pyramide mit quadratischer Basis und AB4 einer quadratischen Ebene:
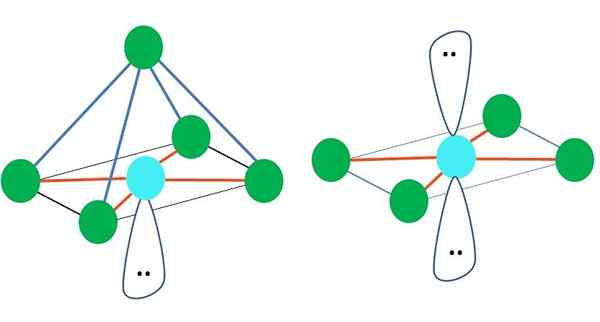 Quelle: Gabriel Bolívar
Quelle: Gabriel Bolívar Im Falle einer oktronistischen elektronischen Geometrie sind diese beiden molekularen Geometrien in Bezug auf die elektrostatische Abstoßung am stabilsten. In der quadratischen flachen Geometrie sind die beiden Elektronenpaare 180 ° getrennt.
Was ist Hybridisierung für Atom in diesen Geometrien (oder Strukturen, wenn es der einzige ist)? Auch hier stellt der Tev fest, dass es sich um SP handelt3D2, Sechs Hybridorbitale, mit denen Sie elektronische Gruppen in den Eckpunkten eines Oktaeders leiten können.
Andere molekulare Geometrien
Modifizieren Sie die Basen der bisher genannten Pyramiden, einige komplexere molekulare Geometrien können erhalten werden. Zum Beispiel basiert die Pentagonal Bipiramid auf einem Pentagon und die Verbindungen, die bilden, haben eine allgemeine Formel AB7.
Wie die anderen molekularen Geometrien wird das Ersetzen von B -Atomen durch elektronenfreie Paare die Geometrie in andere Formen verzerren.
Auch Verbindungen AB8 Sie können Geometrien wie quadratischer Antiprismus übernehmen. Einige Geometrien können sehr kompliziert werden, insbesondere für AB -Formeln7 Von jetzt an12).
Beispiele für molekulare Geometrie
Eine Reihe von Verbindungen wird nachstehend für jede der wichtigsten molekularen Geometrien erwähnt. Als Übung könnten Lewis -Strukturen für alle Beispiele gezogen werden und zertifizieren, wenn angesichts der elektronischen Geometrie molekulare Geometrien erhalten werden, wie sie unten aufgeführt sind.
Lineare Geometrie
-Ethylen, h2Cais2
-Berylliumchlorid, Becl2 (Cl---cl)
-Kohlendioxid, CO2 (O = c = o)
-Stickstoff, n2 (N≡N)
-Quecksilberdibromure, HGBR2 (Br-HG-BR)
-Triyoduro Anion, ich3- (I-i-i-i)
-MADHYDRIC ASAUL, HCN (H-Nwor)
Seine Winkel müssen 180 ° betragen und daher SP -Hybridisierung aufweisen.
Winkelgeometrie
-Wasser
-Schwefeldioxid also2
-Stickstoffdioxid, nein2
-Ozon, oder3
-Amiduro Anion, NH2-
Trigonale Wohnung
-Brom Trifluorid, BF3
-Aluminiumtrichlorid, Alcl3
-Nitratanion, nein3-
-Carbonatanion, CO32-
Tetraedrisch
-Gas Metano, CH4
-Kohlenstoff -Tetrachlorid, CCL4
-Ammoniumkation, NH4+
-Sulfatanion so42-
Trigonale Pyramide
-Ammoniak, NH3
-Hydronio -Kation, h3ENTWEDER+
Trigonale Bipiramid
-Phosphor Pentafluoruro, PF5
-Antimonpentachlorid, SBF5
Schwingen
Schwefel -Tetrafluorid, SF4
Form von t
-Iod -Trichlorid, ICL3
-Chlor -Trifluorid, CLF3 (Beide Verbindungen sind als Interhalogene bekannt)
Oktaedrisch
-Hexafluoruro von Schwefel, SF6
-Selenium hexafluoruro, sef6
-Hexaflorophosphat, Pf6-
Um zu kulminieren, ist die molekulare Geometrie diejenige, die die Beobachtungen der chemischen oder physikalischen Eigenschaften der Materie erklärt. Es ist jedoch nach elektronischer Geometrie ausgerichtet, so dass letztere immer vor dem ersten bestimmt werden müssen.
Verweise
- Whitten, Davis, Peck & Stanley. Chemie. (8. Aufl.). Cengage Learning, S. 194-198.
- Shiver & Atkins. (2008). Anorganische Chemie. (Vierte Edition., P. 23, 24, 80, 169). Mc Graw Hill.
- Markus e. Tuckerman. (2011). Molekulare Geometrie und die VSEPR -Theorie. Erholt von: NYU.Edu
- Virtual Chembook, Charles und. Ophardt. (2003). Einführung in die molekulare Geometrie. Erholt von: Chemie.Elmhursst.Edu
- Chemistry Librettexts. (8. September 2016). Geometrie von Molekülen. Erholt von: Chem.Librettexts.Org

