Globineigenschaften, Struktur, Funktion und Veränderungen
- 4930
- 187
- Joe Hartwig
Der Globin Es ist eine Struktur der Protein Natur, die in kugelförmiger oder kugelförmiger Form angeordnet ist und wo sein Name stammt. Diese Struktur ist von tertiärer Typ und ist durch komplexes Bestand. Es gibt verschiedene Arten von Globinketten, die in griechischen Buchstaben eingestuft wurden: Alfa, Beta, Delta, Gamma, Epsilon und Zeta.
Die Aminosäuren, aus denen die Primärstruktur des Proteins besteht, variieren je nach Spezies, zu der sie gehören (Menschen oder Tiere). Es gibt auch Unterschiede innerhalb derselben Spezies gemäß dem aktuellen Lebenszustand des Organismus (embryonales Leben, fötales Leben oder Nachgeburt).
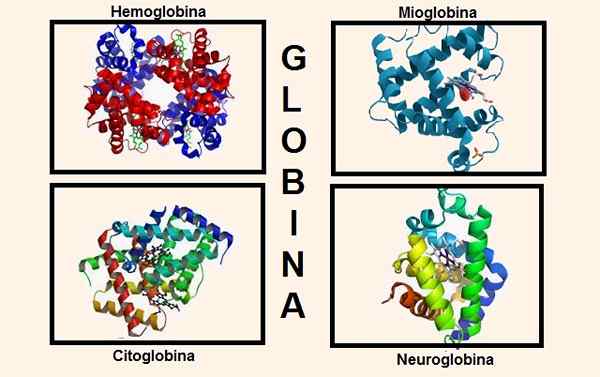
 Verschiedene Strukturen, die Globin in seiner Zusammensetzung enthalten. Quellen: Wikipedia.com/biancadescals [CC BY-SA 4.0 (https: // creativecommons.Org/lizenzen/by-sa/4.0)]/Der ursprüngliche Uploader war Proteinboxbot bei englischer Wikipedia. [Public Domain]/Wikipedia.com
Verschiedene Strukturen, die Globin in seiner Zusammensetzung enthalten. Quellen: Wikipedia.com/biancadescals [CC BY-SA 4.0 (https: // creativecommons.Org/lizenzen/by-sa/4.0)]/Der ursprüngliche Uploader war Proteinboxbot bei englischer Wikipedia. [Public Domain]/Wikipedia.com Genetische Informationen zur Synthese der verschiedenen Globinketten sind in verschiedenen Chromosomen enthalten. Zum Beispiel werden Alpha -Ketten -Globine auf Chromosom 16 gefunden, während die genetischen Informationen von Beta, Delta, Gamma und Epsilon auf Chromosom 11 liegen.
[TOC]
Eigenschaften
Globin ist Teil wichtiger Strukturen im Körper, zum Beispiel am relevantesten sind: Hämoglobin und Myoglobin.
Hämoglobin enthält vier Globinketten (Alfa 1 und Alfa 2) und (Beta 1 und Beta 2). Jeder Globin hat eine Replikation, bei der er die HEMO -Gruppe schützt.
Andererseits gibt es Myoglobin. Das hat eine weniger komplexe Struktur als Hämoglobin. Dies zeigt ein einzelnes kugelförmiges Polypeptid, das sekundär angeordnet ist.
Bis vor kurzem wurde angenommen, dass dies die einzigen Substanzen waren, die Globin in höheren Wesen enthielten, aber heute sind zwei weitere bekannt, die Globin in ihrer Verfassung haben: Cytoglobin und Neuroglobin.
Das Cytoglobin ist in den meisten Geweben vorhanden und befindet sich besonders im Bindegewebe, und es wurde in der Netzhaut gefunden.
Neuroglobin bevorzugt Nervengewebe, daher sein Name. Neuroglobin wurde in Hirnnervzellen gefunden, die sich auf der Ebene des Gehirnrinses befinden.
Kann Ihnen dienen: Linnean -Taxonomie der LebewesenSie sind jedoch nicht die einzigen Orte, denn außerhalb des Nervensystems kann es in Langerhans -Inseln der Bauchspeicheldrüse und in der Netzhaut gefunden werden.
Struktur
Es gibt 6 verschiedene Arten von Globinketten, die mit den Buchstaben des griechischen Alphabets bezeichnet werden: Alpha (α), Beta (β), Gamma (γ), Delta (δ), Epsilon (ε) und Zeta (ζ). Diese Ketten gehören zur Familie der Globinas, unterscheiden sich jedoch in der Anzahl der Aminosäuren, die sie besitzen.
Diese Polypeptide haben eine primäre, sekundäre und tertiäre Struktur. Die einfache Aminosäurkette repräsentiert die Primärstruktur. Wenn die Kette durch Bildung von Spiralen gerollt wird, bilden Propeller die sekundäre Struktur.
Wenn diese Struktur sich um ein Vielfaches auf sich selbst faltet, bildet sie eine kugelförmige Struktur, die der Tertiärstruktur entspricht.
Ebenso können sie nur die quaternäre Form erwerben, wenn 4 Moleküle oder Globinketten in tertiärer Form kombiniert werden.
Dies wird in der komplexen Struktur von Hämoglobin dargestellt. In Myoglobin ist es jedoch anders. In diesem Fall wird Globin als Monomer präsentiert, dh eine einzelne Peptidkette, die in Falten angeordnet ist und 8 Propeller erzeugt (Sekundärstruktur).
Sowohl Hämoglobin- als auch Myoglobin beherbergen eine Hämogruppe in ihrer komplexen Struktur.
Hämoglobin
In diesem Molekül sind 2 Alpha -Globin -Ketten und 2 Beta -Ketten verbunden. So sind sie perfekt gekoppelt, um die HEMO -Gruppe in ihrem Zentrum sowie Eisen zu unterbringen.
Unter diesen Strukturen gibt es schwache Gewerkschaften und starke Gewerkschaften. In den schwachen Gewerkschaften nehmen 19 Aminosäuren teil und die Vereinigung tritt wie folgt auf: Die Alfa 1 -Kette schließt sich der Beta 2 -Kette an und die Alfa 2 -Kette verbindet sich der Beta -Kette 1.
Während 35 Aminosäuren und die Ketten, die sich anschließen.
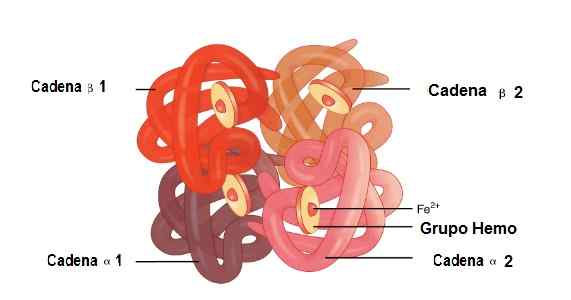 Lage der Alfa 1- und Alfa 2-, Beta 1- und Beta -2 -Ketten in der Hämoglobinstruktur. Quelle: OpenX College [CC von 3.0 (https: // creativecommons.Org/lizenzen/bis/3.0)] bearbeitetes Bild (ins Spanisch übersetzt)
Lage der Alfa 1- und Alfa 2-, Beta 1- und Beta -2 -Ketten in der Hämoglobinstruktur. Quelle: OpenX College [CC von 3.0 (https: // creativecommons.Org/lizenzen/bis/3.0)] bearbeitetes Bild (ins Spanisch übersetzt) Myoglobin
In Myoglobin ist auch eine globuläre Proteingruppe vorhanden, aber in diesem Fall gibt es eine einzelne Peptidkette, die aus 153 Aminosäuren besteht. Seine räumliche Disposition ist zweitrangig und präsentiert 8 Alpha -Propeller.
Es kann Ihnen dienen: Oligoements: Wofür sind sie, wofür sie und wofür sind sie?Diese Proteinstruktur stellt strategisch hydrophobe Aminosäuren in die Struktur, während hydrophile oder polare Aminosäuren nach außen gefunden werden.
Dieses Design ist perfekt, um die Hämogruppe im Inneren unterzubringen (hydrophober Teil). Dies bindet an Protein durch nichtkovalente Bindungen an Protein.
Cytoglobin
Es wurde 2001 entdeckt und es wird gesagt, dass es sich um eine Art Hämoglobin handelt, aber es unterscheidet sich darin, dass es hexacoordiniert ist, während Hämoglobin und Myoglobin pentacoordiniert sind. Dies hat mit der Position der Histidin -Aminosäure in der Nähe der HEMO -Gruppe zu tun.
Neuroglobin
Seine Entdeckung wurde im Jahr 2000 gemacht. Neuroglobin ist ein Monomer mit 150 Aminosäuren, daher ist es Myoglobin sehr ähnlich. Die Struktur von Neuroglobin hat eine Ähnlichkeit zwischen 21 und 25% mit Myoglobin und Hämoglobin.
Funktionen
Da Globin nicht allein im Körper ist, sondern Teil bestimmter Strukturen ist, werden die Funktionen, die jeder von ihnen erfüllt, erwähnt:
Hämoglobin
Es befindet sich in den Erythrozyten. Es ist dafür verantwortlich, Sauerstoff aus der Lunge in das Gewebe zu reparieren und zu transportieren. Sowie den Körper des Kohlendioxids, was den entgegengesetzten Weg macht.
Myoglobin
Die in Globin gelegene Hämogruppe hat die Aufgabe, Sauerstoffmoleküle zu speichern, um den Herzmuskel und den Skelettmuskel zu sauerstoffieren.
Cytoglobin
Es wird angenommen, dass dieses Protein den Schutz von Hypoxie und oxidativen Stresszuständen in Geweben beeinflusst. Es wird auch angenommen, dass arterieller Sauerstoff zum Gehirn transportieren kann.
Neuroglobin
Es wird angenommen, dass Neuroglobin die Fähigkeit hat, Sauerstoff, Monoxid zu reparieren Kohlenstoff- und Stickoxid.
Es ist jedoch noch nicht mit Sicherheit bekannt, was die Funktion von Neuroglobin ist, aber es wird angenommen, dass es mit der Regulierung von Hypoxie und Gehirnsämie zusammenhängt. Besonders als Neuroprotektor wirken.
Kann Ihnen dienen: Lamarck Transformismus -TheorieDa Neuroglobin eine Struktur aufweist, die Hämoglobin und Myoglobin ähnelt, wird spekuliert, dass es an der Versorgung mit Sauerstoff auf neuronaler Ebene teilnehmen kann. Es wird auch angenommen, dass es freie Radikale und Stickstoff eliminieren kann, die in der Atemwege auftreten.
In Bezug auf Stickoxid wird vermut2.
Änderungen
Alpha- und Beta -Ketten von Globin werden von verschiedenen Genen auf den Chromosomen 16 bzw. 11 codiert.
Personen mit Hämoglobin (Falciform oder Drapanozytenanämie) haben einen Defekt in der Beta -Kette von Globin. Der Defekt besteht aus einem Ersatz von Stickstoffbasen auf der Ebene der Nukleotidzahl 20 des beteiligten Gens, wo sich eine Adeninänderung durch ein Timin vorliegt.
Mutationen im β -GenS von Chromosom 11 entsteht verschiedene Halope von Globinas: Senegal, Kamerun, Benín, Bantú oder Auto und asiatisch oder arabisch-indianisch.
Die Kenntnis der Art des Haplotyps, das von Patienten mit Falciform -Anämie präsentiert wird, ist eine wichtige epidemiologische.
Zum Beispiel: Es ist bekannt, dass der Bantu -Halotype ernster ist, während der senegale und asiatische Typ milder sind.
Die Unterschiede zwischen einem Haplotyp und einer anderen Lüge in der Menge an Hämoglobin f, die sie besitzen. Ein höherer Prozentsatz an Hämoglobin F und niedrigerer Hämoglobin -besserer Prognose. Weniger Hämoglobin F und mehr Hämoglobins schlechtere Prognose.
Diese Mutationen werden zusammen mit der Hämoglobin -Mutation s autosomisch vererbt.
Verweise
- "Globin." Wikipedia, freie Enzyklopädie. 19. Oktober 2018, 13:44 UTC. 11. Juli 2019, 17:26, Wikipedia.Org
- „Myoglobin." Wikipedia, freie Enzyklopädie. 7. Juli 2019, 21:16 UTC. 11. Juli 2019, 20:42, Wikipedia.Org
- Durán C, Morales O, Echeverri S, Isaza M. Beta -Globin -Gen -Halotypen in Hämoglobin -Trägern in Kolumbien. Biomedizinische 2012; 32: 103-111. Erhältlich bei: Scielo.Org
- Forrellat M, Hernández P. Neuroglobin: Neues Mitglied der Globinas -Familie. Kubaner Rev. Immunol Hämter 2011; 27 (3): 291-296. Erhältlich bei: Scielo.Sld
- „Cytoglobin." Wikipedia, freie Enzyklopädie. 1. September 2017, 17:26 UTC. 12. Juli 2019, 00:28 Wikipedia.Org
- « Heteropolysaccharide Eigenschaften, Struktur, Funktionen
- Paranoide Schizophrenie -Symptome, Ursachen und Behandlungen »

