Glykolysefunktionen, Enzyme, Phasen, Produkte, Bedeutung
- 1710
- 427
- Medine Kedzierski
Der Glykolyse o Glykolyse ist die wichtigste Route des Glukosekatabolismus, dessen ultimatives Ziel darin besteht.
Diese Route, die in den 1930er Jahren von Gustav Embden und Otto Meyerhof vollständig aufgeklärt wurde, während der Glukosekonsum in Skelettmuskelzellen untersucht wird, besteht aus der vollständigen Oxidation des Monosaccharid.
 Molekulare Struktur des ATP, eines der glykolytischen Produkte (Zusammenfassung des glykolytischen Weges (Quelle: Tekks bei englischer Wikipedia/CC BY-SA.Org/lizenzen/by-sa/3.0) über Wikimedia Commons) über Wikimedia Commons)
Molekulare Struktur des ATP, eines der glykolytischen Produkte (Zusammenfassung des glykolytischen Weges (Quelle: Tekks bei englischer Wikipedia/CC BY-SA.Org/lizenzen/by-sa/3.0) über Wikimedia Commons) über Wikimedia Commons) Es ist eine der wichtigsten Stoffwechselrouten, weil es mit seinen Unterschieden in allen lebenden Organismen eintritt, einzellige oder mehrzellige, Prokaryoten oder Eukaryoten, und es wird angenommen, dass es eine Kette von Reaktionen ist.
Tatsächlich gibt es einige Organismen und Zellenarten, die ausschließlich von diesem Weg abhängen, um zu leben.
In erster Linie besteht die Glykolyse in der Oxidation von Glucose von 6 Kohlenstoffatomen zu Pyruvat mit drei Kohlenstoffatomen; Mit der gleichzeitigen Produktion von ATP und NADH, nützlich für Zellen aus metabolischer und synthetischer Sicht.
In diesen Zellen, die in der Lage sind, die aus dem Glucosekatabolismus erhaltenen Produkte weiter zu verarbeiten, endet die Glykolyse mit der Produktion von Kohlendioxid und Wasser durch den Krebszyklus und die Elektronenförderkette (aerobe Glykolyse).
Zehn enzymatische Reaktionen finden im Verlauf des glykolytischen Weges statt, und obwohl die Regulierung dieser Reaktionen etwas von einer Spezies zu einer anderen unterscheiden kann, sind die Regulationsmechanismen ebenfalls ziemlich erhalten.
[TOC]
Glykolysefunktionen
Aus Sicht der Stoffwechsel ist Glukose einer der wichtigsten Kohlenhydrate für alle Lebewesen.
Es ist ein stabiles und sehr lösliches Molekül, daher kann es relativ leicht im Körper eines Tieres oder einer Pflanze transportiert werden.
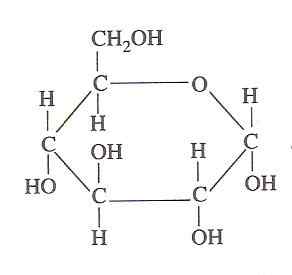 Glucosestruktur (Quelle: Oliva93/CC BY-S (https: // CreePecommons.Org/lizenzen/by-sa/3.0) über Wikimedia Commons)
Glucosestruktur (Quelle: Oliva93/CC BY-S (https: // CreePecommons.Org/lizenzen/by-sa/3.0) über Wikimedia Commons) Die in Glukose enthaltene chemische Energie wird durch Glykolyse aus lebendigen Zellen ausgenutzt, die aus einer Reihe extrem kontrollierter Schritte besteht.
Auf dieser Route wird nicht nur Energie (ATP) und Reduzierung der Kraft (NADH) erhalten, sondern liefert auch eine Reihe von metabolischen Vermittlern, die Teil anderer Routen sind, ebenfalls wichtig aus dem Anabolen (Biosynthese) und dem allgemeinen zellulären Betrieb. Hier ist eine Liste:
- Glucose 6-Phosphat für den Pentosas-Phosphatweg (PPP, Englisch Pantos Mushco Pathway)
- Pyruvat für die Laktikfermentation
- Pyruvat für die Aminosäuresynthese (hauptsächlich Alanin)
- Pyruvat für den Tricarboxonsäurezyklus
- Fructose 6-phosphat, Glucose 6-phosphat und Dihydroxyacetonphosphat, das auf anderen Routen wie Glykogensynthese, Fettsäuren, Triglyceriden, Nucleotiden, Aminosäuren usw. als „Konstruktionsblöcke“ fungiert.
Energie Produktion
Die Menge an ATP, die durch den glykolytischen Weg erzeugt wird.
Wenn es jedoch um aerobe Zellen geht, fungiert die Glykolyse auch als Notfallergiequelle und dient als "Präparationsschritt" vor oxidativen Phosphorylierungsreaktionen, die Zellen mit aeroben Metabolismus charakterisieren.
Enzyme, die an der Glykolyse teilnehmen
Die Glykolyse ist dank der Teilnahme der 10 Enzyme, die die Reaktionen katalysieren, die diesen Weg charakterisieren, nur möglich. Viele dieser Enzyme sind alosterisch und verändern die Form oder Konformation, wenn sie ihre katalytischen Funktionen ausüben.
Es gibt Enzyme, die unter ihren Substraten brechen und kovalente Bindungen bilden, und es gibt andere, die bestimmte Cofaktoren erfordern, um ihre Funktionen auszuüben, hauptsächlich metallische Ionen.
Strukturell gesehen haben alle glykolytischen Enzyme ein Zentrum, das im Wesentlichen durch Blätter gebildet wird β parallel umgeben von Hellices α und in mehr als einer Domäne bestellt. Darüber hinaus sind diese Enzyme charakterisiert, da ihre aktiven Stellen normalerweise an den Gewerkschaftsstellen zwischen Domänen liegen.
Es ist auch wichtig hervorzuheben, dass die Hauptregulation des Weges durch die Kontrolle (Hormon- oder Metaboliten) von Enzymen wie Hexoquinase, Phosphofrocerachinase, Glycerinaldehyd 3-phosphat-Dehydrogenase und Pyruvatkinase führt.
Kann Ihnen dienen: Lungenparenchym: Beschreibung, Histologie, Krankheiten Hauptregulierungspunkte des glykolytischen Pfades.Org/lizenzen/by-sa/3.0) über Wikimedia Commons)
Hauptregulierungspunkte des glykolytischen Pfades.Org/lizenzen/by-sa/3.0) über Wikimedia Commons) 1- Hexoquinase (HK)
Die erste Reaktion der Glykolyse (Glukosephosphorylierung) wird durch Hexoquinase (HK) katalysiert, deren Wirkmechanismus aus einer "induzierten Anpassung" durch das Substrat zu bestehen scheint, die den "Verschluss" des Enzyms um ATP und von Glucose (Glucose (Glucose seine Substrate), sobald sie sich diesen angeschlossen haben.
Abhängig vom Organismus, der berücksichtigt wird, kann es ein oder mehrere Isoenzyme geben, deren Molekulargewicht zwischen 50 (etwa 500 Aminosäuren) und 100 kDa liegt, da sie in Form von Grenzen gruppiert zu sein scheinen, deren Formation von der bevorzugt wird Vorhandensein von Glukose, Magnesiumionen und ATP.
Hexoquinase hat eine Tertiärstruktur, die aus Alpha- und Beta -Blättern besteht, obwohl es in diesen Enzymen viele strukturelle Unterschiede gibt.
2- Isomerase Phosphoglucose (PGI)
Die phosphorylierte Glucose durch Hexoquinase wird mittels Isomerase Phosphoglucose (PGI), auch als Glucose 6-phosphat-Isomerase bekannt. Das Enzym entzieht oder fügt sie also keine Atome, sondern ordnet sie auf struktureller Ebene neu zu.
Dies ist ein aktives Enzym in seiner dimorischen Form (das Monomer wiegt mehr oder weniger 66 kDa) und ist nicht nur an der Glykolyse, sondern auch an der Glukoneogenese in der Synthese von Kohlenhydraten in Pflanzen usw. beteiligt.
3-Phosphofrotequinase (PFK)
Die 6-phosphat-Fructose ist Substrat für das Phosphofrocerachinase-Enzym, das dieses Molekül unter Verwendung von ATP als Phosphorylgruppenspender erneut Phosphorylierung erzeugt und 1,6-Biffosphat-Fructose erzeugt.
Dieses Enzym existiert in Bakterien und Säugetieren als homotrameres Enzym (bestehend aus vier identischen Untereinheiten von jeweils 33 kDa für Bakterien und jeweils 85 kDa in Säugetieren) und in Hefen ist es ein Oktameter (bestehend aus größeren Untereinheiten, zwischen 112 und 118 kDa).
Es ist ein alosterisches Enzym, was bedeutet, dass es positiv oder negativ durch eines seiner Produkte (ADP) und andere Moleküle wie ATP und Citrat reguliert wird.
4-Aldolase
Aldolase auch als Fructose 1,6-Biffosphat-Aldolase-Aldolase bekannt, katalysiert die katalytische Bruch von Fructose 1,6-Biphosphat in Dihydroxyacetonphosphat und Glyceraldehyd 3-phosphat und Reaktionsreaktion, die Union beider Zuckerzucker für die Bildung der Bildung der Bildung der Bildung der Bildung der Bildung der Bildung der 1,6-Biphosphat, 1,6-Biphosphat der Bildung der Bildung der Bildung der Bildung der 1,6-Biphosphat, 1,6-Biphosphat der Bildung der Bildung der Bildung der Bildung der Bildung der 1,6-Biphosphat, 1,6-Biphosphat der Bildung der Bildung der Bildung der Bildung der Bildung der 1,6-Biphosphat, 1,6-Biphosphats.
Mit anderen Worten, dieses Enzym schneidet die Fructose 1,6-Biphosphat in der Mitte und setzt zwei phosphorylierte Verbindungen von 3 Kohlenstoffatomen frei. Aldolase besteht auch aus 4 identischen Untereinheiten, die jeweils mit einem eigenen aktiven Zentrum.
Die Existenz von zwei Klassen (I und II) dieses Enzyms wurde bestimmt, die sich durch den Mechanismus der Reaktion, die katalysiert werden die zweite) sind in Bakterien, Protisten und Metazoos.
Die Aldolase der „überlegenen“ Eukaryoten besteht aus einem Homotermeter von Untereinheiten mit einem Molekulargewicht von 40 kDa.
5- Triosa-Phosphat-Isomerase (Tim)
Die beiden Phosphorylierten Triosas können dank der Wirkung des Isomerase-Tiosa-Phosphat miteinander verbunden werden, wodurch beide Zucker während der gesamten Glykolyse verwendet werden können, um die vollständige Verwendung jedes Glukosemoleküls zu gewährleisten, das in die Straße eintritt.
Dieses Enzym wurde als "perfektes" Enzym beschrieben, da es die Reaktion katalysiert. Das aktive Zentrum befindet sich im Zentrum einer Beta-Barrel-Struktur, ein Merkmal vieler glykolytischer Enzyme.
Es handelt.
6-Glyceraldehyd 3-phosphat-Dehydrogenase (GAPDH)
Das 3-phosphat-Glyceraldehyd, das durch die Wirkung des Isomerase-Tiosa-Phosphat erzeugt wird sowie 2 Phosphat- oder Sulfationen.
In diesem Durchgang des Weges ermöglicht das Enzym die Phosphorylierung eines seiner Substrate, die anorganische Phosphat als Phosphorylgruppenspender verwendet wurden, wobei die gleichzeitige Reduktion von zwei NAD+ -Molekülen und die Produktion von 1,3-Bifospphoglycerato-.
7-Fosfoglycerato-Kinase (PGK)
Fosphoglycerate Kinase ist für die Übertragung einer der 1,3-bifosphoglyzerischen Phosphatgruppen in ein ADP-Molekül aufgrund der Phosphorylierung auf Substratebene verantwortlich. Dieses Enzym verwendet einen Mechanismus, der dem von Hexoquinase verwendet wird, wie es schließt, um sich an seinen Substraten zu kontaktieren, und schützt sie vor interferenzigen Wassermolekülen.
Kann Ihnen dienen: Aponeurose: Eigenschaften, Funktionen, OrtDieses Enzym hat wie andere, die zwei oder mehr Substrate verwenden, eine Bindungsstelle für den ADP und eine andere für Phosphatzucker.
Im Gegensatz zu den anderen beschriebenen Enzymen ist dieses Protein ein 44 kDa -Monomer mit einer bilobularen Struktur, die aus zwei Domänen derselben Größe besteht, die durch eine schmale "Rille" verbunden ist.
8-Mutase-Phosphoglyceration
Die 3-Phosphoglyceration erfährt eine Änderung von der Phosphatgruppe zu Carbon 2 in der Mitte des Moleküls, was eine strategische Instabilitätsstelle darstellt, die die anschließende Übertragung der Gruppe zu einem ATP.
Dieses Heckreglo wird durch das Enzym Phosphoglycerate mutasa, ein Dimérica -Enzym für Menschen und Tetramer für Hefen, katalysiert, mit einer Untereinheitgröße nahe 27 kDa.
9-Enolase
Enolasekatalysierung Dehydratisierung von 2-phosphoglycerat zu Phosphoenolpiruvat, notwendiger Schritt für die Erzeugung von ATP in der folgenden Reaktion.
Es ist ein Dimérica -Enzym, das aus zwei identischen Untereinheiten von 45 kDa besteht. Es hängt von Magnesiumionen für Stabilität und für die Konformationsänderung ab, die erforderlich ist, um sich Ihrem Substrat anzuschließen. Es ist eines der Enzyme, die im Cytosol vieler Organismen und Ausübung zusätzlicher Funktionen für glykolytische Funktionen mit größerer Häufigkeit exprimiert werden.
10- Quinasa Piruvato
Die zweite Phosphorylierung auf Substratebene, die in der Glykolyse stattfindet.
Dieses Enzym ist komplexer als jedes andere glykolytische Enzyme und bei Säugetieren ist es ein homotramales Enzym (57 kDa/Untereinheit). In Wirbeltieren gibt es mindestens 4 Isoenzyme: L (in der Leber), R (in Erythrozyten), M1 (im Muskel und Gehirn) und M2 (Fetalgewebe und adulte Gewebe).
Glykolysephasen (Schritt für Schritt)
Die glykolytische Route besteht aus zehn aufeinanderfolgenden Schritten und beginnt mit einem Glukosemolekül. Während des Prozesses wird das Glukosemolekül mit zwei Phosphaten "aktiviert" oder "hergestellt", wobei zwei ATP -Moleküle investiert.
Anschließend wird es in zwei Fragmenten "geschnitten" und schließlich einige Male chemisch modifiziert, synthetisiert, auf der Straße, vier ATP -Moleküle, so.
Aus dem obigen kann abgeleitet werden, dass die Route in eine Energie -Investitionsphase unterteilt ist, die für die vollständige Oxidation des Glucosemoleküls und eine weitere Phase des Energieverstärks von grundlegender Bedeutung ist, in der die anfangs verwendete Energie und zwei ATP -Netze wieder aufgenommen wird Moleküle.
- Energieinvestitionsphase
1- Der erste Schritt der glykolytischen Route besteht aus der Phosphorylierung von durch Hexoquinase (HK) vermittelter Glucose. Es ist eine irreversible Reaktion und hängt vom Vorhandensein von Magnesiumionen (Mg2+) ab:
Glucose + ATP → Glucose 6-Phosphat + ADP
2- 6-phosphat-Glucose, die so produziert wurden, wird dank der Wirkung des Isomerase-Phosphoglucose-Enzyms (PGI) (PGI) in 6-phosphat-Fructose isomerisiert. Dies ist eine reversible Reaktion und impliziert keinen zusätzlichen Energieverbrauch:
Glukose 6-phosphat → Fructose 6-phosphat
3- Anschließend impliziert ein weiterer Energieinvestitionsschritt die Phosphorylierung von Fructose 6-phosphat, um 1,6-Biphosphat-Fructose zu bilden. Diese Reaktion wird durch das Enzym Phosphospofrotequinase-1 (PFK-1) katalysiert. Wie der erste Schritt der Route ist das Phosphatgruppen -Spendermolekül das ATP und es ist auch eine irreversible Reaktion.
Fructose 6-Phosphat + ATP → Fructose 1,6-Biphosphat + ADP
4- In diesem Schritt der Glykolyse gibt. Diese aldolische Kondensation wird durch das Enzym Aldolase katalysiert und ist ein reversibler Prozess.
Fructose 1,6-Biffosphat → Dihydroxyaceton-Phosphat + Glyceraldehyd 3-phosphat
5- Die letzte Reaktion der Energieinvestitionsphase besteht in der Interkonversion des Triosas-DHAP.
Dihydroxyaceton-Phosphat ↔ Glyceraldehyd 3-phosphat
- Energiegewinnphase
6- 3-phosphat-Glyceraldehyd wird auf dem glykolytischen Weg als Substrat für eine Oxidationsreaktion und eine andere Phosphorylierung verwendet, die durch dasselbe Enzym, Glyceraldehyd 3-Phosphat-Dehydrogenase (Gapdh), katalysiert wird (Gapdh).
Das Enzym katalysiert die Oxidation von Kohlenstoff c1 des Moleküls zu einer Carboxylsäure und die Phosphorylierung davon in derselben Position, wodurch 1,3-bifosciziert werden. Im Verlauf der Reaktion werden 2 NAD+ -Moleküle pro Glukosemolekül reduziert und 2 anorganische Phosphatmoleküle verwendet.
Kann Ihnen dienen: Luftröhre2glycerinaldehyd 3-phosphat + 2nad + + 2pi → 2 (1,3-bifosphoglycerin) + 2nadh + 2H
In aeroben Organismen fließt jeder auf diese Weise produzierte NADH durch die Elektronenförderkette, um als Substrat für die Synthese von 6 ATP -Molekülen aufgrund einer oxidativen Phosphorylierung zu dienen.
7- Dies ist der erste Schritt der Synthese von ATP in der Glykolyse und impliziert die Wirkung der Kinase-Phosphoglycerin (PGK) auf 1,3-Bifosphoglyceration, wobei eine Phosphorylgruppe (Phosphorylierung auf dem Substratebene) von diesem Molekül auf ein Molekül-ADP übertragen wird, das 2ATPS-Substratniveau ergibt, das 2ATP-Wert ergibt, 2ATP-Niveau, 2ATP-Wert und 2 Moleküle von 3-phosphoglycerate (3pg) für jedes Glukosemolekül.
2 (1,3-Bifosphoglycerin) + 2ADP → 2 (3-Phosphoglyceration) + 2ATP
8- Die 3-Phosphoglyceration dient als Substrat für das Enzymphosphoglycerin-Mutasa (PGM) Magnesiumionen (Mg+2).
2 (3-phosphoglycerate) → 2 (2-phosphoglycerate)
9- Das Enzym in einem 2-phosphoglyceraten Dehydrat und produziert Phosphoenolpiruvat (PEP) durch eine Reaktion, die die Zugabe von zusätzlicher Energie nicht verdient und die darauf abzielt, eine Hochenergie-Verbindung zu produzieren, die in der Lage ist, seine Phosphorylgruppe bei der nächsten Reaktion zu spenden.
2 (2-phosphoglycerate) → 2fosfoenolpiruvat
10-phosphoenolpiruvat ist ein Substrat des Pyruvatkinase-Enzyms (PYK), das für den Transfer der Phosphorylgruppe in diesem Molekül auf ein ADP.
In den Reaktion 2ATP- und 2 Pyruvatmolekülen werden für jede Glukose produziert, und das Vorhandensein von Kalium und Magnesium in ionischer Form ist notwendig.
2fospo Elplivato + 2ADP → 2pyruvat + 2ATP
Die Nettoleistung der Glykolyse besteht auf diese Weise aus 2ATP und 2NAD+ für jedes Glukosemolekül, das in die Route eintritt.
Wenn dies Zellen mit aeroben Metabolismus sind, erzeugt der Gesamtabbau eines Glukosemoleküls zwischen 30 und 32 ATP durch den Krebszyklus und die Elektronentransportkette.
Glykolyseprodukte
Die allgemeine Reaktion der Glykolyse ist wie folgt:
Glucose + 2NAD + + 2ADP + 2PI → 2Pyruvat + 2ATP + 2NADH + 2H+
Wenn es also kurz analysiert wird, könnte es sicherstellen, dass die Hauptprodukte der glykolytischen Route Pyruvat, ATP, Nadh und H sind.
Das metabolische Ziel jedes Reaktionsvermediärs hängt jedoch weitgehend von den zellulären Bedürfnissen ab, weshalb alle Vermittler als Reaktionsprodukte angesehen werden können, um sie wie folgt zu prägen:
- Glukose 6-phosphat
- Fructose 6-Phosphat
- Fructose 1,6-Biphosphat
- Dihydroxyacetonphosphat und Glyceraldehyd 3-phosphat
- 1,3-Bifosphoglycerin
- 3-phosphoglycerate und 2-phosphoglycerate
- Phosphoenolpiruvat und Pyruvat
Bedeutung
Obwohl die Glykolyse an sich (könnte über anaerobe Glykolyse sprechen) nur etwa 5% der ATP produziert, die aus dem aeroben Katabolismus von Glukose extrahiert werden können, ist diese metabolische Route aus mehreren Gründen von grundlegender Bedeutung:
- Es dient als "schnelle" Energiequelle, insbesondere in Situationen, in denen ein Tier schnell einen Ruhezustand lassen muss, für den aerobe Oxidationsprozesse nicht schnell genug wären.
- Skelett "weiße" Muskelfasern im menschlichen Körper sind zum Beispiel schnelle Kontraktionsfasern und hängen von der anaeroben Glykolyse ab, um zu funktionieren.
- Wenn eine Zelle aus irgendeinem Grund glykolytisch braucht.
- Viele Zellen hängen von Glukose als Energiequelle durch einen glykolytischen Weg ab, einschließlich der rote Blutkörperchen, mangelnde innere Organellen und Augenzellen (insbesondere die der Hornhaut), die keine große Mitochondriendichte haben.
Verweise
- Canback, b., Andersson, s. G. UND., & Kurland, C. G. (2002). Die globale Phylogenie von glykolytischen Enzymen. Proceedings der National Academy of Sciences, 99 (9), 6097-6102.
- Chaudhry R, Varacallo M. Biochemie, Glykolyse. [Aktualisiert 2019 AP 21]. In: Statpearls [Internet]. Treasure Island (FL): Statpearls Publishing; 2020 Jan-. Verfügbar bei: https: // www.NCBI.NLM.NIH.GOV/BOOKS/NBK482303/
- Fothergill-Gilmore, l. ZU., & Michels, p. ZU. (1993). Entwicklung der Glykolyse. Fortschritte in der Biophysik und Molekularbiologie, 59 (2), 105-235.
- Kim, j. W., & Dang, c. V. (2005). Facettenreiche Rollen von glykolytischen Enzymen. Trends in biochemischen Wissenschaften, 30 (3), 142-150.
- Kumari, a. (2017). Süße Biochemie: Erinnern an Strukturen, Zyklen und Wege durch Mnemonik. Akademische Presse.
- Li, x. B., Gu, j. D., & Zhou, q. H. (2015). Überprüfung der aeroben Glykolyse und der wichtigsten Ziele der Enzyme für die Lungenkrebstherapie. Brustkrebs, 6 (1), 17-24.
- « Merkmale von Pflanzenfressern, Typen, Beispiele
- Eigenschaften des Tabakmosaikvirus, Struktur, Replikation »

