Glucosides Training, Funktion und Typen/Gruppen
- 1472
- 287
- Joy Hort
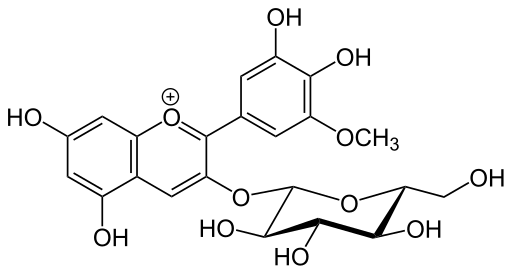
Der Glucoside Es sind sekundäre Metaboliten von Pflanzen, die durch glucosidische Verbindungen an monokosacchariden befestigt sind, dh, dass es sich um glykosylierte Metaboliten handelt. Sie gehören zur chemischen Familie der Glykoside, die alle chemischen Verbindungen umfassen, die an zuckerhaltigen Abfällen gebunden sind.
In der typischen Struktur eines Glykosidmoleküls werden zwei Regionen erkannt: Algikon und Glycon. Die Region, die aus dem Saccharidrest besteht, heißt Glycona und die Region, die dem Nicht -Saccharid -Molekül entspricht.
 Struktur eines Glykosids (Quelle: Yikrazuul [Public Domain] über Wikimedia Commons)
Struktur eines Glykosids (Quelle: Yikrazuul [Public Domain] über Wikimedia Commons) Im Allgemeinen wird der Begriff "Glucosid" verwendet, um darauf zu verweisen, dass während der Hydrolyse dieser Verbindungen Glukosemoleküle freigesetzt werden , unter anderen.
Die Nomenklatur von Glucosiden bezeichnet typischerweise die Art ihrer Agliconregion. Diese Namen mit der Kündigung "-ina" sind Stickstoffverbindungen vorbehalten, während Alkaloide mit dem Suffix "-Oside" benannt werden.
Diese Suffixe begleiten oft die Wurzel des lateinischen Namens des botanischen Ursprungs, in dem die Moleküle zum ersten Mal beschrieben werden und das Präfix "Gluco" normalerweise hinzugefügt wird.
Die glucosidische Bindung zwischen Glycon- und Aglicon -Teilen kann zwischen zwei Kohlenstoffatomen auftreten (C-Glucoside) oder Sauerstoffatome können teilnehmen ((ENTWEDER-Glucoside), von der seine Stabilität von der chemischen oder enzymatischen Hydrolyse abhängt.
Die relative Häufigkeit von Glykosiden in Angiospermen ist viel größer als bei Gymnospermen, und es wurde gezeigt, dass in Bezug.
Es ist wichtig, die große Vielfalt und Heterogenität dieser Gruppe von Verbindungen zu betonen, da die Identität jedes jeden von dem Aglicon -Teil abhängt, der äußerst variabel ist.
[TOC]
Ausbildung
Biosynthese oder Bildung von glucosidischen Verbindungen (Peng, Peng, Kawagoe, Hogan & Delmer, 2002) in Pflanzen abhängig von der Art der Glucóside, die berücksichtigt wird, und in Pflanzen hängen seine Biosynthesequoten häufig von den Bedingungen um die Umweltbedingungen ab und in den Umweltbedingungen hängen sie ab und in Pflanzen hängen sie ab und in den Umweltbedingungen.
Cyanogene Glykoside werden beispielsweise aus Aminosäurevorläufern, einschließlich L-Marosin, L-Valin, L-Isoleucin und L-Fenylalanin, synthetisiert. Aminosäuren sind hydroxyliert, um zu bilden N-Hydroxil -Aminosäuren, die anschließend in Aldaximas umgewandelt werden, die dann in Nitrile umgewandelt werden.
Es kann Ihnen dienen: einheimische Peru -PflanzenNitrile werden hydroxyliert, um die α-Hydroxinitrilos zu bilden, die glykosyliert werden können, um den entsprechenden cyanogenen Glucóside zu bilden. Zwei multifunktionale Cytochrome, die als P450- und Glycosyltransferase -Enzyme bekannt sind, sind an diesem Biosyntheseweg beteiligt.
Zum größten Teil implizieren die Biosynthesewege der Glucoside die Beteiligung von Glycosyltranspherase -Enzymen, die in der Lage sind, Kohlenhydratabfälle aus einem von einem UDP -Molekül aktivierten Vermittler selektiv zu übertragen, auf den entsprechenden AGLICON -Teil, der aktiviert ist.
Die Übertragung aktivierter Zucker wie UDP-Glucose auf einen Akzeptor-Aglicon-Teil hilft, Metaboliten in den letzten Schritten der sekundären Metaboliten zu stabilisieren, zu entgiften und zu löschen, die Routen produzieren.
Sie sind also die Glycosyltransferase -Enzyme, die für die große Vielfalt der Glucoside in Pflanzen verantwortlich sind, und wurden daher ausführlich untersucht.
Einige synthetische Methoden In vitro existieren, um Glykosidderivate von Pflanzen zu erhalten, die umgekehrte Hydrolysesysteme implizieren oder trans Glykosylierung von Verbindungen.
Funktion
In Pflanzen hat beispielsweise eine der Hauptfunktionen von Flavonoidglykosiden mit dem Schutz vor ultraviolettem Licht, gegen Insekten und gegen Pilze, Viren und Bakterien zu tun. Sie dienen als Antioxidantien, attraktive Bestäuber und Controller von Pflanzenhormonen.
Andere Funktionen von Flavonoidglucosiden sind die Stimulation der Produktion von Knoten durch Bakterienspezies der Gattung Rhizobium. Sie können an enzymatischen Hemmungsprozessen und als allelopathische Wirkstoffe teilnehmen. Daher bieten sie auch eine pflanzenfressende chemische Verteidigungsbarriere an.
Viele Glucoside erzeugen bei hydrolysierten Glukoseresten, die von Pflanzen als metabolisches Substrat für die Energieproduktion oder sogar für die Bildung struktureller Bedeutung in Zellen verwendet werden können.
Anthropozentrisch gesehen ist die Funktion dieser Verbindungen sehr vielfältig, da einige in der Lebensmittelindustrie eingesetzt werden, andere jedoch im Pharmazeutikum für das Design von Arzneimitteln zur Behandlung von Bluthochdruck, Kreislaufstörungen, Anti -Krebs -Wirkstoffe usw. verwendet werden.
Typen/Gruppen
Die Klassifizierung von Glykosiden findet sich in der Literatur basierend auf Teilen ohne Saccharid (Agliconas) oder in Bezug auf den botanischen Ursprung dieser. Das Folgende ist eine Form der Klassifizierung, die auf dem Aglicon -Teil basiert.
Die Hauptglykosidengruppen entsprechen Herzglucosiden, cyanogenen Glykosiden, Glucosinolaten, Saponinen und Anthrachinonglycosiden. Einige Flavonoide treten häufig auch als Glucoside auf.
Es kann Ihnen dienen: Begonia rex: Eigenschaften, Lebensraum, Sorten, Fortpflanzung, PflegeHerzglucoside
Diese Moleküle bestehen im Allgemeinen aus einem Molekül (Agliconregion), dessen Struktur Steroid ist. Sie sind in Pflanzen der Scrophularia -Familie vorhanden, Inbesondere in Digitalis purpurea, sowie in der Familie Convealiaceae mit Majalis wird sich einberufen Als klassisches Beispiel.
Diese Art von Glucóside hat eine hemmende negative Wirkung auf Natrium/Kalium -Atasy -Pumpen in Zellmembranen, die in Herzzellen besonders häufig vorkommen, sodass die Aufnahme von Pflanzen mit diesen sekundären Verbindungen direkte Auswirkungen auf das Herz hat; Von dort sein Name.
Cyanogene Glucoside
Sie werden chemisch als α-Hydroxy-Nitrilosglykoside definiert, die aus Aminosäureverbindungen stammen. Sie sind in Angiospermas -Arten der Rosaceae -Familie vorhanden, insbesondere in Arten der Gattung Prunus, sowie in der Familie Poaceae und anderen.
Es wurde festgestellt, dass diese Teil der charakteristischen toxischen Verbindungen einiger Sorten von sind Streitmanihot, Am besten in Südamerika als Maniok, Maniok oder Maniok bekannt. In ähnlicher Weise sind sie in Äpfelsamen und in Nüssen wie Mandeln reichlich vorhanden.
Die Hydrolyse dieser sekundären Metaboliten endet in der Produktion von Cyanhydsäure. Wenn die Hydrolyse enzymatisch ist.
Der Glykonabschnitt von cyanogenen Glykosiden ist typischerweise D-Glycose, obwohl er auch älter, primär und andere, meist durch β-Glucosid-Verbindungen vereint.
Der Verbrauch von Pflanzen mit zyanogenen Glykosiden kann negative Auswirkungen haben, darunter die Interferenz in die Verwendung von Jod, was zu einer Hypothyreose führt.
Glucosinolate
Die Grundlage seiner Agliconstruktur besteht aus Aminosäuren, die Schwefel enthalten, sodass sie auch Tioglucoside genannt werden können. Die Hauptfamilie von Pflanzen, die mit der Herstellung von Glucosinolaten verbunden sind, ist die Brassicaceae -Familie.
Unter den negativen Wirkungen für Organismen, die diese Pflanzen aufnehmen. Darüber hinaus können diese Verbindungen die Haut reizen und Hypothyreose und Gicht induzieren.
Saponine
Viele Verbindungen "Seifentrainer" sind Glucoside. Der Aglicon -Teil von glucosidischen Saponinen besteht aus pentacyclischen oder tetraischen Steroiden. Sie sind strukturell heterogen, aber sie haben funktionelle Eigenschaften gemeinsam.
In ihrer Struktur haben sie stark hydrophile Glyconas und stark hydrophobe Agliconregionen, die Emulgatoreigenschaften liefern, sodass sie als Reinigungsmittel verwendet werden können.
Kann Ihnen dienen: Gemeinsame Eiche: Merkmale, Lebensraum, Verteilung, KultivierungDie Saponine sind in einer Vielzahl von Pflanzenfamilien vorhanden, darunter die Arten der Liliaceae -Familie, die in der Art veranschaulicht wird Narthecium osfragu.
Antraquinon -Glucosid
Sie sind im Pflanzenreich weniger verbreitet in Bezug auf die anderen oben genannten Glykoside. Sie sind in vorhanden Renex crispus und Arten der Gattung Rheum. Die Wirkung seiner Einnahme entspricht einer übertriebenen Sekretion von Wasser und Elektrolyten, die von Peristaltik im Dickdarm begleitet werden.
Flavonoide und Pro-Anthocyane
Viele Flavonoide und ihre Oligomere, Pro-Anthocyane, treten als Glykoside auf. Diese Pigmente sind in weiten Teilen des Pflanzenreichs sehr häufig, mit Ausnahme von Algen, Pilzen und einigen Antoceros.
Sie können in der Natur als C-U-Glucoside existieren, abhängig von der Art der glucosidischen Bindung, die zwischen Glykon- und Algikonregionen auftritt.
Die Agliconstruktur der C-Glucoside-Flavonoide entspricht drei Ringen mit einer phenolischen Gruppe, die ihnen das antioxidative Eigenschaft liefert. Die Vereinigung der Saccharidgruppe zur Aglyconregion erfolgt durch Kohlenstoffkohlenstoffbindungen zwischen dem anomeren Kohlenstoff von Zucker und Kohlenstoff C6 oder C8 des aromatischen Kern des Flavonoids.
Verweise
- Conn, e. UND. (1979). Biosynthese von cyanogenen Glykosiden. Natürliche Wissensschaften, 66, 28-34.
- Forslund, k., Morant, m., Jørgensen, geb., Olsen, c. UND., ASAMIZU, e., & Sato, s. (2004). Biosynthese der Nitrilglycoside Rhodiocyanosid zu und D und der cyanogenen Glycoside Lotustralin und Linamarin in Lotus japonicus. Pflanzenphysiologie, 135(Mai), 71-84.
- Markham, k. R. (1989). Methoden in der Pflanzenbiochemie. 6. Flavonen, Flavonole und ihre Glykoside (Vol. 1). Academic Press Limited. Von www abgerufen.Dx.doi.org/10.1016/B978-0-12-461011-8.50012-3
- Peng, l., Peng, l., Kawagoe und., Hogan, p., Delmer, d. (2002). B-Glucosid-Sitosterol als erste für die Cellulose-Synthese in Pflanzen. Wissenschaft, 295, 147-150.
- Richman, a., Swanson, a., Humphrey, t., Chapman, r., McGarvey, geb., Pocs, r., & Brandle, j. (2005). Funktionelle Genomik entdeckt drei Glucosyltransferase. Das Plant Journal, 41, 56-67.
- Swain, t. (1963). Taxonomie der chemischen Pflanze. London: Akademische Presse.
- Van Rantwijk, f., Oosterom, m. W., & Sheldon, r. ZU. (1999). Glycosidase-katalysierte Synthese von Alkylglycosiden. Journal of Molekularkatalyse B: enzymatisch, 6, 511-532.
- Vetter, j. (2000). Pflanzliche cyanogene Glykoside. Toxikon, 38, 11-36.
- Wolfenden, r., Lu, x., & Jung, g. (1998). Spontane Hydrolyse von Glykosiden. J. BIN. Chem. SOC., 120, 6814-6815.
- « Oxidative Phosphorylierungsstadien, Funktionen und Inhibitoren
- Soziale, wirtschaftliche und ökologische Auswirkungen der Gentechnik »

