GLUT 2 Merkmale, Struktur, Funktionen
- 4810
- 768
- Nick Laurén
GLUT2 Es ist ein Glukosetransporter mit niedriger Affinität, der in Pankreas-, Leber-, Nieren- und Darmzellmembranen sowie Astrozyten und Tanitos exprimiert wird. Neben der Vermittlung des Glukosetransports ist er auch am Transport von Fructose, Galactose und Glucosamin beteiligt. Mehr als ein Glukoseförderer ist also ein mittlerer Transporter.
Die Tatsache, eine geringe Affinität für Glukose zu präsentieren. Teilnahme an der regulatorischen Kontrolle vieler physiologischer Ereignisse, die auf Schwankungen der Blutzuckerkonzentration reagieren.
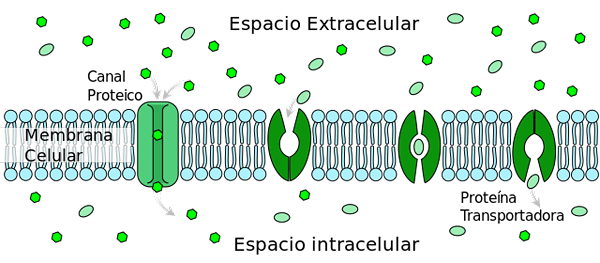
 Der erleichterte Diffusiontransport von Glukose Typ 2 (GLUT2) verändert die Konformation, die die Glukosebindungsstelle von der Außenseite zur inneren Membranseite mobilisiert (Förderprotein). Von Ladyofhats [Public Domain] (https: // CreateRecommons.Org/lizenzen/by-sa/3.0)] aus Wikimedia Commons.
Der erleichterte Diffusiontransport von Glukose Typ 2 (GLUT2) verändert die Konformation, die die Glukosebindungsstelle von der Außenseite zur inneren Membranseite mobilisiert (Förderprotein). Von Ladyofhats [Public Domain] (https: // CreateRecommons.Org/lizenzen/by-sa/3.0)] aus Wikimedia Commons. Unter den zahlreichen regulierenden Prozessen sind: 1) die Freisetzung von Insulin durch Pankreaszellen durch hohe Glukosekonzentrationen; 2) Glucagon -Sekretion durch Hepatozyten zur Glukoseproduktion bei Hypoglykämie.
[TOC]
Transport von Glukose in das Zellinterne
Ungefähr 75% Glukose, die in die Zelle eintreten, um die Stoffwechselwege der Energieerzeugung zu ernähren, und dies durch einen passiven Transportmechanismus, der durch umfassende Membranproteine, die als Transporter bezeichnet werden, erleichtert werden.
Dieser Transportmechanismus ist allgemein bekannt, was zur Verbreitung vorliegt. Es erfordert keinen Energiebeitrag, der durchgeführt wird, und wird zugunsten eines Konzentrationsgradienten verabreicht. Das heißt, von einer hohen Konzentrationszone bis zu einer niedrigen Konzentration.
Bisher wurden mindestens 14 Isoformen von Diffusionstretransatoren, einschließlich GLUT2, erleichtert. Alle von den Hauptleiter der Superfamilie (MSF) und im Konsens genannt GLUTS (vom Akronym in Englisch von "Glukosetransportern").
Es kann Ihnen dienen: Myitose: Phasen, Eigenschaften, Funktionen und OrganismenDie verschiedenen bisher charakterisierten Grüße werden von SLC2A -Genen codiert und weisen deutliche Unterschiede in der Aminosäuresequenz auf, die Präferenz für die Substrate, die sie transportieren, sowie in der Zell- und Gewebeverteilung.
GLUT2 -Eigenschaften
GLUT2 mobilisiert Glukose durch einen einzigen Transportmechanismus (Uniporta). Diese Funktion wird auch GLUT1 erfüllt, der am häufigsten vorkommende Glukoseförderer bei praktisch allen Säugetieren.
Im Gegensatz zu diesem hat es jedoch eine extrem geringe Affinität aufgrund von Glukose, was bedeutet, dass es nur in der Lage ist, sie zu transportieren, wenn Konzentrationen dieses Zuckers normalerweise sehr hohe Werte im extrazellulären Medium erreichen.
Obwohl es eine geringe Affinität zur Glukose hat, zeigt es eine hohe Transportkapazität, was impliziert, dass es große Mengen dieser Hexose mit hoher Geschwindigkeit transportieren kann. Diese beiden Merkmale scheinen mit der Rolle zusammenhängen, die dieser Transporter auf subtile Veränderungen der Glukosekonzentration reagieren muss.
Molekulare Charakterisierungsstudien dieses Transporters haben gezeigt, dass dies keine einzige Spezifität aufgrund von Glukose darstellt. Im Gegenteil, es ist in der Lage, den passiven Transport von Fructose, Galactose, Hand und Glycosamin zu vermitteln. Präsentation einer geringen Affinität für die ersten drei und hohen Affinität zum Glucosamin.
Da all diese Moleküle Zucker von sechs Kohlenstoffatomen sind, kann er eher als hexöser Transporter als als Glukosetransporter angesehen werden.
GLUT2 -Struktur
GLUT2 zeigt eine 55% ige Peptidsequenz, die mit der des Hochaffinitätstransporters für Glucose GLUT1 identisch ist.
Trotz dieses geringen Prozentsatzes der Ähnlichkeit zwischen den Sequenzen beider Transporter haben Studien, die von X -Ray -Kristallographie durchgeführt wurden, gezeigt, dass sie eine ähnliche Struktur aufweisen.
Kann Ihnen dienen: ZytoskelettDiese Struktur entspricht der eines Multipaso-Transmembraalproteins in α-Helix. Das heißt, es kreuzt die Membran mehrmals durch Transmembransegmente mit α-Helix.
Wie bei allen Mitgliedern der Superfamilie der Hauptvermittler (MSF), zu der es gehört, überqueren 12 helikale Segmente die Membran. Sechs davon sind räumlich neu ordnen, um eine hydrophile Pore zu bilden, durch die Zucker mobilisiert werden.
Es ist zu beachten. Beide, die derselben Seite der Membran ausgesetzt sind, erzeugen einen Hohlraum, in dem die Anordnung der sechs Zuckeratome erkannt werden.
Eine Änderung der Struktur des Förderers hängt mit dem von diesem Mechanismus verwendeten Mechanismus zusammen, um den Zucker von einer Seite der Membran zu transportieren. Diese strukturelle Deformation ermöglicht die Mobilisierung des Gewerkschaftsortes auf die zytoplasmatische Seite, wo die Freisetzung des Moleküls, das schnell transportiert wurde.
GLUT2 Funktionen
Zusätzlich zur Vermittlung von Glukose-, Galactose- und Glucosamin -Entführung in der Zelle wurden zahlreiche physiologische Funktionen auf die Expression dieses Transporters in verschiedenen zellulären Typen zurückgeführt.
Viele dieser Funktionen wurden unter Verwendung von Genunterdrückungstechniken bestimmt. Letzteres bestehen darin, die Expression des Gens zu verhindern, dessen Funktion in den Zellen eines bestimmten Gewebes oder eines vollständigen Organismus untersuchen soll.
In diesem Sinne hat die Blockade der Glut2 -Expression bei Mäusen gezeigt, dass dieses Protein das Hauptmittel für den Glukosetransport sowohl in Nieren- als auch in Leberzellen darstellt. Zusätzlich zum Transport von Galactose und Fructose steht nicht mit der Erzeugung von Glucose aus diesen Zucker über die Glukoneogenese zusammen.
Kann Ihnen dienen: StromatolitenDarüber hinaus wurde gezeigt, dass es eine regulatorische Rolle verschiedener physiologischer Funktionen ausübt, da seine niedrige Glucose -Affinität es erkennen kann, wann die Konzentrationen dieses Zucker hoch sind.
GLUT2 -Papier zur Aufrechterhaltung der Zellhomöostase
Da es eine kritische Funktion bei der Erzeugung von Energie durch alle Zellen, insbesondere für Nervenzellen, erfüllt, muss seine Blutkonzentration nahe an einem Wert von 5 mmol/l gehalten werden. Variationen in dieser Konzentration werden immer durch regulatorische Proteine durch "Glukoseerkennung" -Mechanismen überwacht.
Diese Mechanismen bestehen aus molekularen Strategien, die es ermöglichen, schnell auf plötzliche Variationen der Glukosekonzentration zu reagieren. In diesem Sinne verleiht die Expression von GLUT2 in der Zellmembran, deren Funktionen durch Hyperglykämie aktiviert werden, eine regulatorische Rolle.
Tatsächlich wurde gezeigt, dass die Insulinsekretion durch Pankreaszellen durch Glukosedetektion durch GLUT2 ausgelöst wird.
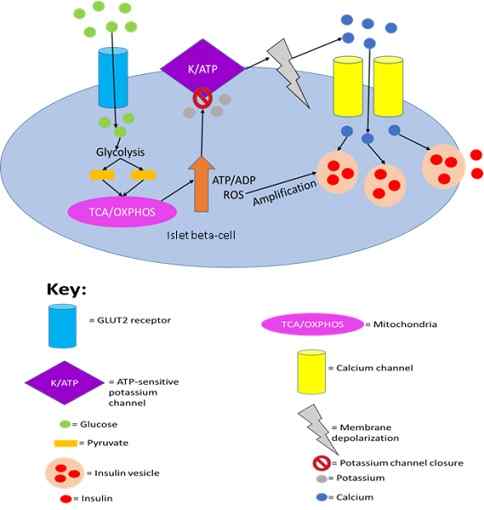
Die Insulinsekretion durch Pankreaszellen wird durch Glukosedetektion durch GLUT2 abgefeuert. Von Joshua J Reed [CC BY-SA 4.0 (https: // creativecommons.Org/lizenzen/by-sa/4.0)] aus Wikimedia Commons.
Zusätzlich durchschnittlich die autonomische Nervenzusammenscheinung der Nahrung, die Thermoregulation und den Betrieb von Pankreaszellen.
Wenn die GLUT2 -Spiegel in Nervenzellen abnehmen, erzeugen sie ein positives Signal, um die Glucagon -Sekretion auszulösen. Wenn man sich daran erinnert, dass Glucagon ein Hormon ist, das die Glukoseproduktion durch die Leber aus Glykogenreserven fördert.
Verweise
- Burcelin R, Thorens B. Beweis dafür. Diabetes. 2001; 50 (6): 1282-1289.
- Kellett GL, Brot-Loche E, Mace OJ, Leturque A. Zuckerabsorption im Darm: Die Rolle von GLUT2. Annu Rev Nution. 2008; 28: 35-54.
- Lamy CM, Sanno H., Labouèbe G, Picard A, Magnan C, Chatton JY, Thorens B. Hypoglykämie-aktivierte Glut2. Zellstoffwechsel. 2014; 19 (3): 527-538.
- Mueckler M, Thorens B. Die SLC2 (GLUT) -Familie von Membrantransportern. Mol Aspekte Med. 2013; 34 (2-3): 121-38.
- Tarussio D, Metref S., Seyer P., Mounien L., Vallelis D., Magnan C., Foretz M., Thorens B. Die nervöse Glukoseemerkennung reguliert die postnatale Proliferation von β -Zellen und die Glukosehomöostase. J Clin Invest. 2014; 124 (1): 413-424.
- B. GLUT2 in Bauchspeicheldrüsen- und Extra-Pancrea-Glucucu-Detektion (Übersicht). Mol Memb Biol. 2001; 18 (4): 265-273.
- Thorens B, Mueckler M. Glukosetransporter im 21. Jahrhundert. Am J Physiol Endocrinol Metab. 2010; 298 (2): e141-e145.
- Thorens b. GLUT2, Glukoseemerkennung und Glukose -Homöostase. Diabetologie. 2015; 58 (2): 221-232.
- « Albarikoque -Eigenschaften, Lebensraum, Eigenschaften, Kultivierung
- Kojotenmerkmale, Lebensraum, Lebensmittel, Reproduktion »

