Glutathioneigenschaften, Struktur, Funktionen, Biosynthese
- 4543
- 1231
- Tizian Liebich
Er Glutathion (Gh) Es handelt sich um ein kleines Tripeptidmolekül (mit nur drei Nicht -Protein -Abfällen), das an vielen biologischen Phänomenen wie enzymatischer Mechanik, Makromoleküle -Biosynthese, intermediärem Stoffwechsel, Sauerstofftoxizität, intrazellulärem Transport usw. beteiligt ist.
Dieses kleine Peptid, das in Tieren, in Pflanzen und in einigen Bakterien vorhanden ist, wird als "als" betrachtet "Puffer" Oxid-Reduktor, da es eine der wichtigsten Verbindungen mit niedrigem Molekulargewicht ist, die Schwefel enthalten und mit Cysteinresten verbunden sind.
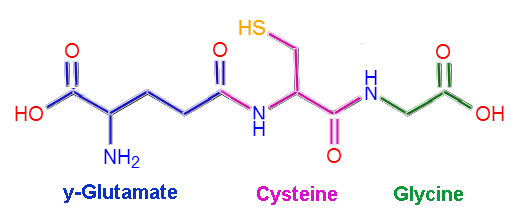
 Molekulare Struktur von Glutathion (Quelle: Claudio Pistilli [CC BY-SA 4.0 (https: // creativecommons.Org/lizenzen/by-sa/4.0)] über Wikimedia Commons)
Molekulare Struktur von Glutathion (Quelle: Claudio Pistilli [CC BY-SA 4.0 (https: // creativecommons.Org/lizenzen/by-sa/4.0)] über Wikimedia Commons) Einige Krankheiten beim Menschen wurden mit dem Mangel an bestimmten Enzymen des Glutathion -Stoffwechsels in Verbindung gebracht, und dies ist auf ihre vielfältigen Funktionen bei der Aufrechterhaltung der Körperhomöostase zurückzuführen.
Unterernährung, oxidativer Stress und andere Pathologien, die von Menschen gelitten wurden.
Auf die gleiche Weise ist Glutathion ein unverzichtbarer Faktor für sein Wachstum und seine Entwicklung, da es auch Funktionen in mehreren Biosynthesewegen erfüllt und für die Entgiftung von Zellen und die interne Homöostase von wesentlicher Bedeutung ist, wo es als starkes Antioxidans wirkt.
[TOC]
Eigenschaften
Die ersten Studien, die in Bezug auf die subzelluläre Position von Glutathion durchgeführt wurden, zeigten, dass es in den Mitochondrien vorhanden ist. Anschließend wurde es auch in der Region beobachtet, die der Kernmatrix und in Peroxisomen entspricht.
Gegenwärtig ist bekannt, dass sich das Kompartiment, in dem seine Konzentration häufiger in Cytosol ist.
In Säugetierzellen liegt die Glutathionkonzentration im Bereich von Millimol, während im Blutplasma seine reduzierte Form (GSH) in mikromolaren Konzentrationen vorkommt.
Diese intrazelluläre Konzentration ähnelt der Konzentration von Glukose, Kalium und Cholesterin, unverzichtbare Elemente für die Zellstruktur und den Metabolismus.
Einige Organismen haben analoge Moleküle oder Glutathionvarianten. Protozoan -Parasiten, die Säugetiere beeinflussen.
Bestimmte Pflanzenarten haben zusätzlich zu Glutathion homologen Molekülen, die am C-terminalen Ende andere Abfälle als Glycin haben (Homoglutation), und die durch die Darstellung von Funktionen, die denen des betreffenden Tripeptids ähneln, gekennzeichnet sind.
Trotz der Existenz anderer Verbindungen ähnlich wie Glutathion in verschiedenen Organismen ist dies eines der "Thiolen", das intrazellulär in größerer Konzentration ist.
Die hohe Beziehung, die normalerweise zwischen der reduzierten Form (GSH) und der oxidierten Form (GSSG) von Glutathion besteht.
Struktur
Gutation oder L-German-Glutamil-Cisteinylglycin besteht, wie der Name schon sagt. Cystein- und Glycinreste binden durch gemeinsame Peptidverbindungen, dh zwischen der α-Carboxylgruppe einer Aminosäure und der α-Amino-Gruppe der anderen, aneinander.
Der Zusammenhang zwischen Glutamat und Cystein ist jedoch nicht typisch für Protein, da es zwischen dem γ-Carboxyl-Teil der Gruppe r des Glutamats und der α-Amino-Gruppe des Cysteins auftritt, so dass diese Verbindung γ genannt wird Verknüpfung.
Dieses kleine Molekül hat eine Molmasse von etwas mehr als 300 g/mol und das Vorhandensein der γ -Verbindung scheint für die Immunität dieses Peptids gegen die Wirkung vieler Aminopeptidase -Enzyme von entscheidender Bedeutung zu sein.
Kann Ihnen dienen: Solidarität zwischen ArtenFunktionen
Wie bereits erwähnt, ist Glutathion ein Protein, das an zahlreichen zellulären Prozessen von Tieren, Pflanzen und bestimmten Prokaryoten beteiligt ist. In diesem Sinne kann Ihre allgemeine Teilnahme in:
-Proteinsynthese und Abbauprozesse
-Die Bildung von Ribonukleotid -Vorläufern von DNA
-Die Regulation der Aktivität einiger Enzyme
-Der Schutz von Zellen in Gegenwart von reaktiven Sauerstoffspezies (ROS) und anderen freien Radikalen
-Signaltransduktion
-Genetische Expression und in
-Programmierte Zellapoptose oder Tod
Coenzym
Es wurde auch festgestellt.
Das Glutathion, das die Zelle verlassen kann (was dies in seiner reduzierten Form tut), kann an Oxid-Reduktions-Reaktionen in der Nähe der Plasmamembran und der umgebenden Zellumgebung teilnehmen, die Schadenszellen vor verschiedenen Arten von Oxidationsmittel schützt.
Cysteinspeicher
Dieser Tripéptido arbeitet auch als Cysteinspeicherquelle und trägt zur Aufrechterhaltung des reduzierten Zustands der Proteinsulfhydhylgruppen innerhalb der Hämogruppe der Hämogruppe der Proteine, die diesen Cofaktor enthalten.
Proteinfaltung
Bei der Teilnahme an der Proteinfaltung scheint es eine wichtige Funktion als Reduktionsmittel von Disulfidbrücken zu haben, die in Proteinstrukturen unangemessen gebildet wurden, was normalerweise auf Oxidationsmittel wie Sauerstoff, Wasserstoffperoxid, Peroxinitrit und einige Superoxide zurückzuführen ist.
Funktion in Erythrozyten
In Erythrozyten produziert das durch das Enzymreduktase -Glutathionperoxidase produzierte Glutathion (GSH) oxidiertes Wasser und Glutathion (GSSG).
Die Zersetzung von Wasserstoffperoxid und damit die Vorbeugung ihrer Akkumulation in Erythrozyten verlängert die Lebensdauer dieser Zellen, da sie die oxidativen Schäden vermeidet, die in der Zellmembran auftreten können und die in der Hämolyse enden können.
Xenobiotischer Stoffwechsel
Glutathion ist auch ein wichtiger Protagonist im xenobiotischen Metabolismus dank der S-transferaseful.
Es ist weise.
Oxidativer Zustand der Zellen
Da Glutathion in zwei Formen existiert, ein reduziertes und ein oxidiertes ist, bestimmt die Beziehung zwischen beiden Molekülen den Redoxzustand von Zellen. Wenn das GSH/GSSG -Verhältnis größer als 100 ist, gelten die Zellen als gesund, aber wenn es nahe 1 oder 10 liegt, kann es ein Indikator sein, dass sich die Zellen in einem Zustand oxidativer Stress befinden.
Biosynthese
Die Tripidide-Glutathie wird in zellulären und Tieren durch die Wirkung von zwei Enzymen synthetisiert: (1) die γ-Glutamilcistin-Synthetase und (2) die Synthetase-Glutathion (GSH-Synthetase), während sein Abbau oder die „Dekomposition“ abhängt, abhängig von der Aktion der Aktion abhängt. des γ-Glutamil-Transpeptidase-Enzyms.
In Pflanzenorganismen wird jedes der Enzyme von einem einzelnen Gen kodiert, und Defekte in einem der Proteine oder ihrer kodierenden Gene können in den Embryonen Letalität verursachen.
Kann Ihnen dienen: PhylogenieIm menschlichen Wesen wie bei anderen Säugetieren der Hauptstelle der Synthese und des Exports der Glutathion -Frage.
Synthese von novo von Glutathion, ihre Regeneration oder Recycling, erfordern Energie von ATP auftreten.
Reduzierter Glutathion (GSH)
Das reduzierte Glutathion stammt wie bereits erwähnt aus dem Aminosäurenglycin, Glutamat und Cystein, und seine Synthese beginnt mit der Aktivierung (unter Verwendung von ATP) der γ-Carboxylgruppe von Glutamat (der Gruppe R), um einen Acylphosphat-Intermediary zu bilden, und bildet eine Acylphosphat-Intermediary, und bildet was es von der α-Amino-Gruppe des Cysteins angegriffen wird.
Diese erste Kondensationsreaktion von zwei Aminosäuren wird durch die γ-Glutamilcistein-Synthetase katalysiert und wird normalerweise durch die intrazelluläre Verfügbarkeit der Aminosäuren Glutamat und Cystein beeinflusst.
Das so gebildete Dipéptid wird anschließend dank der Wirkung der Synthetase GSH mit einem Glycinmolekül verdichtet. Während dieser Reaktion tritt auch eine ATP-Aktivierung der α-Carboxylgruppe des Cysteins auf.
Oxidierter Glutathion (GSSG)
Wenn der reduzierte Glutathion an Oxid-Reduktions-Reaktionen beteiligt ist, besteht die oxidierte Form tatsächlich aus zwei aneinander verbundenen Glutathionmolekülen durch Disulfurbrücken; Aus diesem Grund wird die rostige Form mit dem Akronym "GSSG" abgekürzt.
Die Bildung der oxidierten Glutathionspezies hängt von einem als nur Peroxidase oder GSH Peroxidase bekannten Enzym ab, der eine Peroxidase ist Asset platzieren.
Die Interkonversion zwischen oxidierten und reduzierten Formen wird dank der Teilnahme einer GSSG -Reduktase- oder Reduktase -Glutathion angegeben.
Vorteile Ihrer Aufnahme
Glutathion kann oral, topisch, intravenös, intranasal oder vernebelt werden, um ihre systemische Konzentration bei Patienten mit oxidativem Stress zu erhöhen, zum Beispiel.
Krebs
Untersuchungen, die in Bezug auf die orale Glutathion -Verabreichung durchgeführt werden.
HIV
Im Allgemeinen haben Patienten, die mit dem erworbenen Immundefizienzvirus (HIV) infiziert sind.
In einer von Morris und Mitarbeitern durchgeführten Studie wurde gezeigt, dass die Versorgung mit Glutathion an Makrophagen von HIV -positiven Patienten die Funktion dieser Zellen erheblich verbesserte, insbesondere angesichts von Infektionen mit opportunistischen Krankheitserregern wie z M. Tuberkulose.
Muskelaktivität
Andere Studien haben mit der Verbesserung der kontraktilen Aktivität von Muskeln, antioxidativen Abwehr und oxidativen Schäden zu tun,.
Leberpathologien
Es wurde wiederum angesehen, dass seine intravenöse Aufnahme oder Verabreichung Funktionen bei der Vorbeugung des Fortschritts einiger Krebsarten und bei der Verringerung von Zellschäden aufgrund bestimmter Leberpathologien auftritt.
Kann Ihnen dienen: Essentielle Fettsäuren: Funktionen, Wichtigkeit, Nomenklatur, BeispieleAntioxidans
Obwohl nicht alle berichteten Studien bei menschlichen Patienten durchgeführt wurden, sind dies jedoch normalerweise Tests in Tiermodellen (im Allgemeinen murine), die Ergebnisse in einigen klinischen Studien, die die Wirksamkeit des exogenen Glutathion als Antioxidans erhalten.
Aus diesem Grund wird es zur Behandlung von Katarakten und Glaukom, als „Anti-Aging“ -Produkt, zur Behandlung von Hepatitis, zahlreichen Herzerkrankungen, Gedächtnisverlust und zur Stärkung des Immunsystems und zur Reinigung nachher verwendet Vergiftung mit Schwermetallen und Drogen.
"Absorption"
Der GLUTATHIón, der exogen nicht in die Zellen verabreicht wurde, ist nicht in die Zellen eindringen. Daher ist die direkte Wirkung der Verabreichung (oral oder intravenös) dieser Verbindung die Zunahme der intrazellulären Konzentration von GSH dank des Beitrags der notwendigen Aminosäuren für ihre Synthese, die effektiv zum Cytosol transportiert werden können.
Nebenwirkungen
Obwohl berücksichtigt wird, dass die Glutathionaufnahme "sicher" oder harmlos ist, wurden nicht genügend Studien zu ihren Nebenwirkungen durchgeführt.
Von den wenigen berichteten Studien ist jedoch bekannt, dass es negative Auswirkungen haben kann, die sich aus der Wechselwirkung mit anderen Medikamenten ergeben und die Gesundheit in verschiedenen physiologischen Kontexten schädlich sein kann.
Wenn es langfristig eingenommen wird, scheint es, dass die Zinkspiegel in übermäßigem Rückgang wirken.
Verweise
- Allen, j., & Bradley, r. (2011). Auswirkungen von oralem Glutathion. Das Journal of Alternative and Komplementary Medicine, 17(9), 827-833.
- Conklin, k. ZU. (2009). Antioxidantien der Nahrung während der Krebschemotherapie: Einfluss auf die Wirksamkeit der Chemotherapeutika und die Entwicklung von Nebenwirkungen. Ernährung und Krebs, 37(1), 1-18.
- Meister, a. (1988). Glutathionstoffwechsel und seine selektive Modifikation. Das Journal of Biological Chemistry, 263(33), 17205-17208.
- Meister, a., & Anderson, m. UND. (1983). Glutathion. Ann. Rev Biochem., 52, 711-760.
- Morris, d., Krieg, c., Khurasany, m., Guilford, f., & Saviola, b. (2013). Makrophagenfunktionen der Glutathiona Supplementation Improvement in HIV. Journal of Interferon & Cytokine Research, elf.
- Murray, r., Bender, d., Botham, k., Kennelly, p., Rodwell, v., & Weil, p. (2009). Harpers illustrierte Biochemie (28. ed.). McGraw-Hill Medical.
- Nelson, d. L., & Cox, m. M. (2009). Lehninger Prinzipien der Biochemie. Omega -Ausgaben (5. Aufl.). https: // doi.org/10.1007/S13398-014-0173-7.2
- Noctor, g., Mhamdi, a., Chauch, s., Han und. Yo., Neukermans, j., Marquez-Garcia, geb.,... Foyer, c. H. (2012). Glutathion in Pflanzen: Ein integrierter Überblick. Pflanze, Zelle und Umgebung, 35, 454-484.
- Pizzorno, j. (2014). Glutathion! Ermittlungsmedizin, 13(1), 8-12.
- Qanungo, s., Starke, d. W., Pai, h. V, myyal, j. J., & Nieminen, zu. (2007). Glutathion. Das Journal of Biological Chemistry, 282(25), 18427-18436.
- Ramires, p. R., & Ji, l. L. (2001). Die Supplementierung und das Training von Glutathiona erhöhen den Myokardresistenz gegen Ischämie-Reperfusion in vivo. Ann. J. Physiol. Herzzirk. Physiol., 281, 679-688.
- Sies, h. (2000). Glutathion und seine Rolle bei zellulären Funktionen. Freie Radikale Biologie & Medizin R, 27(99), 916-921.
- Wu, g., Fang und., Yang, s., Lupton, j. R., & Turner, n. D. (2004). Glutathionstoffwechsel und seine Auswirkungen auf die Gesundheit. Amerikanische Gesellschaft für Ernährungswissenschaften, 489-492.
- « Gleichmäßig beschleunigte geradlinige Bewegungseigenschaften, Formeln, Formeln
- Eigenschaften, Typen, Funktionen »

