Hydroxylgruppe

- 2174
- 134
- Nick Laurén
Wir erklären, was eine Hydroxylgruppe, ihre Eigenschaften, Struktur und mehrere Beispiele sind
 Chemische Struktur der Hydroxylgruppe
Chemische Struktur der Hydroxylgruppe Was ist eine Hydroxylgruppe?
A Hydroxylgruppe Es handelt sich um eine funktionelle Gruppe oder ein Teil anderer funktioneller Gruppen, die in vielen organischen und anorganischen Verbindungen vorhanden sind. Es wird durch ein Wasserstoffatom und eines Sauerstoffs gebildet (daher sein Name).
Hydroxylgruppen sind normalerweise unter anderem mit einem Kohlenstoffatom oder einem anderen nicht -metallischen Element wie Schwefel oder Phosphor verbunden und sind eine der wichtigsten funktionellen Gruppen in der organischen Chemie.
Diese Gruppe von Atomen ist in organischen funktionellen Gruppen wie Alkoholen, Phenolen und Carboxsäuren vorhanden und ist diejenige, die jeder dieser funktionellen Gruppen ihre chemischen Eigenschaften Eigenschaften Eigenschaften gibt. In verschiedenen Strukturen kann es als -Oh oder ho dargestellt werden-
Eigenschaften von Hydroxylgruppen
- Es besteht aus einem Sauerstoffatom und einem von Wasserstoff, die miteinander verbunden und durch kovalente Bindungen mit einem anderen Atom in einem Molekül verbunden sind.
- Die Verbindung zwischen Wasserstoff und Sauerstoffatom ist eine polare Bindung, bei der Sauerstoff eine negative partielle Belastung und positive partielle Lastwasserstoff aufweist, wodurch die Hydroxylgruppe A polare Funktionsgruppe macht.
- Es hat eine Struktur ähnlich der von Wasser. Aus diesem Grund sind viele der Verbindungen, die sie enthalten, normalerweise in diesem Lösungsmittel löslich.
- Es verfügt über einen Wasserstoff, der direkt mit dem Sauerstoffatom verbunden ist, sodass die Hydroxylgruppe eine Wasserstoffbindung bilden kann.
- Mit zwei freien Elektronen am Sauerstoffatom kann die Hydroxylgruppe zwei zusätzliche Wasserstoffbrückenbindungen bilden, die als Akzeptor von Wasserstoffatomen fungieren.
- Sie können als Säure fungieren, indem Sie einer Basis ein Proton geben. Abhängig von der funktionellen Gruppe, zu der es gehört und das Atom, mit dem es direkt verknüpft ist, kann die Hydroxylgruppe unterschiedliche Säuregehalt. Zum Beispiel hat es bei Alkoholen eine PKA von 15 oder mehr (heftige Säure als Wasser), in Phenolen variiert es zwischen 7 und 10, während es in Carboxylsäuren normalerweise zwischen 4 und 5 liegt.
- Sie können auch als Lewis -Basis fungieren und eines seiner Elektronenpaare spenden, um sich mit einem anderen Proton oder einer anderen Lewis -Säure zu verbinden.
Hydroxylgruppenstruktur
Wie unter den Eigenschaften erwähnt, bilden Sauerstoff und Wasserstoffatome in der Hydroxylgruppe eine polare kovalente Bindung.
Darüber hinaus bildet das Sauerstoffatom eine zweite kovalente Bindung mit einem anderen Atom, das Teil eines Moleküls als Alkohol ist, Phenol zu einer anderen Verbindung. Die Lewis -Struktur dieser Gruppe ist nachstehend dargestellt:
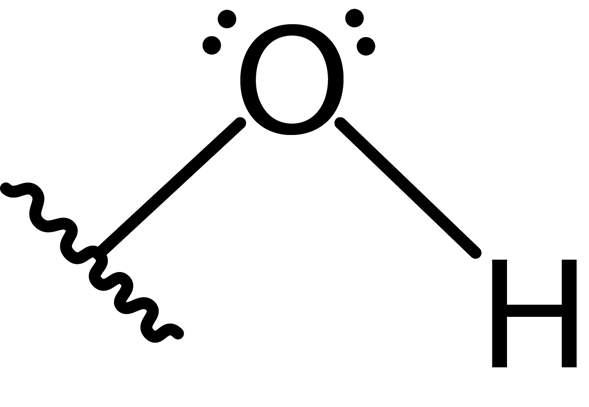
Aufgrund des Vorhandenseins der beiden Paare freier Elektronen am Sauerstoffatom und der beiden kovalenten Bindungen hat die Hydroxylgruppe eine Winkelgeometrie mit einem Winkel von ungefähr 104 °, etwas niedriger als der tetraedrale Winkel. Die Länge der Sauerstoffhydrogenbindung beträgt ca. 0.97 Angstrome.
Hydroxylgruppe, Hydroxylradikal- und Hydroxidanion
Es ist sehr häufig, die Hydroxylgruppe mit Hydroxylradikal- und Hydroxidanion zu verwechseln, da alle durch die gleichen beiden Atome gebildet werden, diese Begriffe beziehen sich jedoch nicht auf dasselbe.
Einerseits unterscheidet sich das Hydroxylradikal von der Hydroxylgruppe, in der es ein freies Radikal mit einer ungeraden Anzahl von Valenzelektronen ist, und ist auch nicht mit einem anderen Atom oder einer Gruppe von Atomen verbunden (weshalb es frei gesagt wird).
Trotz dieser Unterschiede verwenden viele Menschen fälschlicherweise den Hydroxyl -Radikalterm, um sich auf die Hydroxylgruppe zu beziehen, wenn sie in einem Molekül vorhanden sind.
Hydroxidanion hingegen ist ein Ion mit einer negativen Belastung, die durch Wasserstoff und Sauerstoff gebildet wird, während die Hydroxylgruppe eine neutrale Gruppe ist.
Während die Hydroxylgruppe immer mit einer kovalenten Bindung mit einem Molekül verbunden ist, haben Verbindungen, die Hydroxidionen enthalten.
Kann Ihnen dienen: Was sind die Anode und die Kathode??Beispiele für Hydroxylgruppen
Alkohole
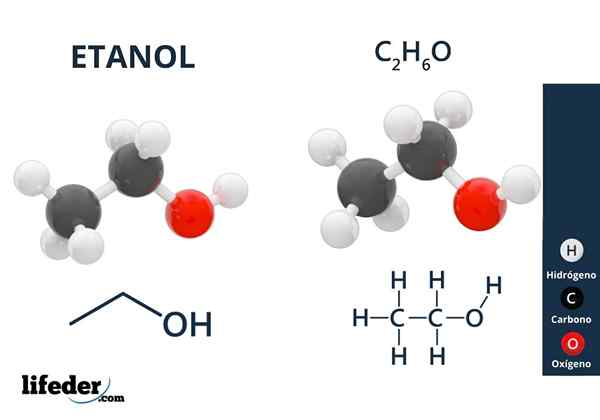 Ethanol
Ethanol Alkohole haben Hydroxylgruppen, die mit einem aliphatischen Kohlenstoff verbunden sind. Beispiele für Alkohole sind:
- Methylalkohol.
- Ethanol.
- Isopropylalkohol.
Phenole
Die Phenole sind durch eine Hydroxylgruppe gekennzeichnet, die direkt mit einem aromatischen Ring verbunden ist. Einige Beispiele für gemeinsame Phenole sind:
- Phenol.
- Alfa und Beta-Naftol.
- Ortho, Ziel und für Cresol.
Kohlenhydrate
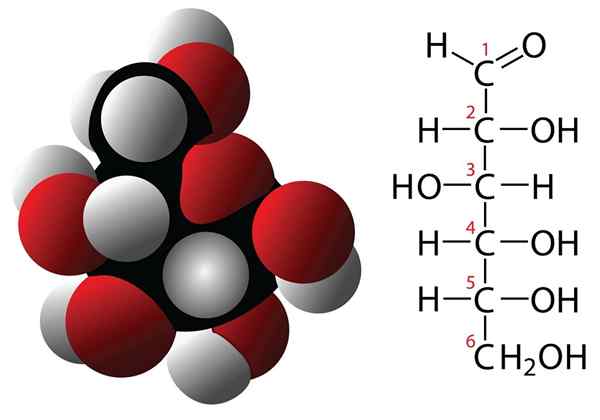 Glukose- und Molekularformelmolekül
Glukose- und Molekularformelmolekül Kohlenhydrate sind Verbindungen mit 3 oder mehr Kohlenstoffatomen, die durch eine empirische Formel gekennzeichnet sind, die durch Kohlenstoffe und Wassermoleküle gebildet wird. Diese Verbindungen haben oft mehrere Hydroxilli -Gruppen, was sie im Wasser sehr löslich macht. Einige Beispiele für Kohlenhydrate sind:
- Glucose.
- Fructose.
- Saccharose.
Carbonsäuren
Die in Carboxsäuren vorhandene Carboxylfunktionsgruppe entspricht einer der saursten funktionellen Gruppen, die ein organisches Molekül haben kann. Diese Verbindungen sind normalerweise schwach.
Der Säure der Carboxylgruppe ist auf das Vorhandensein einer Hydroxylgruppe zurückzuführen, die mit einer Carbonylgruppe verbunden ist, die die negative Last des Anions stabilisiert. Einige Beispiele für Carboxsäuren sind:
- Essigsäure.
- Benzoesäure.
- Trifluoressigsäure.
Sulfonsäuren
Sulfonsäuren sind organische Verbindungen, die durch die Reaktion zwischen einigen organischen Verbindungen und Schwefelsäure oder Schwefeldioxid gebildet werden. Diese Arten von Verbindungen haben eine Hydroxylgruppe und sind im Allgemeinen ziemlich starke Säuren, vergleichbar mit Schwefelsäure.
Einige Beispiele für Sulfonsäuren sind:
- Pentosulfonsäure.
- Ortho, Ziel- und Toluensulfonsäure -Isomere.
- Benzulfonsäure.
Anorganische Säuren
Hydroxylgruppen erscheinen nicht nur in organischen Verbindungen. Viele anorganische Verbindungen besitzen sie ebenfalls, insbesondere Oxazidensäuren. In diesen Fällen ist die Hydroxylgruppe direkt mit einem Nicht -Metall verbunden, der normalerweise von Kohlenstoff unterscheidet.
Einige Beispiele für Anorganinsäuren, die Hydroxylgruppen zusammen mit dem Nicht -Metall haben, mit dem sie verknüpft ist, sind:
- Hypochlorsäure, bei der die Hydroxylgruppe mit einem Chloratom verbunden ist.
- Schwefelsäure mit zwei Hydroxylgruppen, die mit einem Schwefelatom verbunden sind.
- Phosphorsäure, bei denen die drei Hydroxylgruppen mit einem Phosphor -Atom verbunden sind.

